阅读下面材料,回答问题。
硫元素广泛存在于自然界中,在火山口附近有硫单质存在,地球表面的含硫化合物主要以矿物质形式存在,如石膏(CaSO4•2H2O)、芒硝(Na2SO4•10H2O)等。硫单质是一种淡黄色的固体,不溶于水,易溶于二硫化碳(CS2)。火山喷发时,部分硫元素转化成硫化氢气体;部分硫元素转化成二氧化硫和三氧化硫气体,二氧化硫在大气中易被氧化成三氧化硫,二氧化硫和三氧化硫溶于水,分别生成亚硫酸和硫酸。
(1)从物质类别和硫元素化合价角度,对硫及其化合物进行分类,根据表中物质组成规律,补充缺项。
物质类别 |
单质 |
氢化物 |
氧化物 |
酸 |
盐 |
化学式 |
S |
H2S |
SO2 |
H2SO3 |
|
SO3 |
H2SO4 |
Na2SO4 |
(2)结合材料中硫单质的性质分析,如果洗去粘在试管壁上的硫,应选用的试剂是 。
(3)硫化氢中硫元素的化合价为 ;硫化氢的水溶液称为氢硫酸,氢硫酸露置在空气中与氧气发生置换反应,产生淡黄色沉淀,写出化学方程式 ;氢硫酸敞口放置在空气中,溶液的pH (填“增大”“减小”或“不变”)。
(4) 从物质类别的角度预测, 下列物质与二氧化硫 、 三氧化硫均能发生化学反应的是 (填序号)。
a.O2 b.NaOH c.H2O d.HCl
(5)H2SO3不稳定,易分解产生气体(与H2CO3类似)。写出稀硫酸与亚硫酸钠(Na2SO3)溶液发生复分解反应的化学方程式 。
二氧化硫属于空气污染物,应处理后排放。32g硫与足量的氧气完全反应,生成二氧化硫的质量是多少?
某化学兴趣小组的同学对酸、碱和盐的性质进行探究,请你参与。
【查阅资料】CO2+Na2CO3+H2O═2NaHCO3;
20℃时,部分物质的溶解度。
|
物质 |
Ca(OH)2 |
NaOH |
Na2CO3 |
NaHCO3 |
|
溶解度/g |
0.16 |
109 |
21.8 |
9.6 |
探究一:探究氢氧化钙的性质
20℃时,在盛有5g Ca(OH)2固体的A烧杯中加入40mL水,用玻璃棒搅拌,静置,取上层部分清液于B烧杯中。
(1)向A烧杯中滴加几滴酚酞溶液,观察到的现象是 ,再加入过量稀盐酸,反应的化学方程式为 。
(2)向B烧杯中通入CO2,观察到澄清石灰水变浑浊。
(3)由上述实验可知氢氧化钙的性质有 。
[实验拓展]
(4)向上述(1)反应后的A烧杯中滴加碳酸钠溶液,测得其pH随反应时间的变化如图1.AB段的实验现象是 ,BC段发生反应的化学方程式为 。
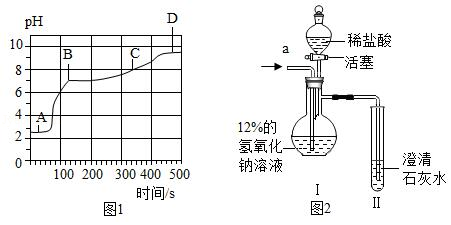
探究二:二氧化碳通入一定溶质质量分数的氢氧化钠溶液中溶质成分的探究
[设计和实验]20℃时,甲、乙两组同学设计如图2装置分别进行实验。
甲组:从a端缓慢通入CO2,一段时间后Ⅱ中变浑浊,停止通CO2,Ⅰ中溶质为X.打开活塞,滴加足量稀盐酸。
[解释与结论](1)经分析X是NaHCO3.实验过程中,Ⅰ中产生的现象是 。
乙组:从a端缓慢通入CO2,一段时间后Ⅱ中无明显现象,停止通CO2,Ⅰ中溶质为Y.打开活塞,滴加足量稀盐酸,Ⅱ中变浑浊。
[解释与结论](2)乙组同学认为Y只有Na2CO3.你认为该结论是否合理,结合分析Y的成分说明理由 。Ⅰ中一定发生反应的化学方程式为 。
金属材料的应用推动了社会的发展。新型材料的研制,已成为现代高新技术的重要物质基础。
(1)目前常用的1元硬币为钢芯镀镍合金,具有耐腐蚀、 等优点。
(2)镁和铝可熔炼成Mg17Al12镁合金,熔炼过程只能在真空中,不能在空气中进行的原因是 (写其中一个化学方程式)。
(3)某废弃物中可能含有Cu、CuO、Mg、Zn中的一种或几种,为确定其成分并回收金属,取样品进行如图实验。

①步骤Ⅱ的操作是 。
②步骤Ⅱ中产生的现象是 。步骤Ⅲ中锌和稀硫酸反应的化学方程式为 。
③若溶液C中只含一种溶质,则样品的成分是 。
④通过测氢气的质量,也可确定样品的成分,则w的值为 (用m和n的代数式表示)。
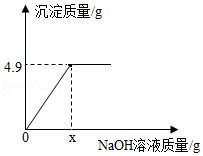
欲测定一瓶标签破损的硫酸铜溶液的溶质质量分数,现取50g硫酸铜溶液样品于烧杯中,逐滴加入10%的NaOH溶液。生成沉淀的质量与加入NaOH溶液的质量之间的关系如图所示。回答下列问题:
(1)图中x= 。
(2)计算硫酸铜溶液的溶质质量分数。(写出计算过程)
黄曲霉素AFTB(化学式为C17H12O6)是污染粮食(大米、花生等)的真菌莓素,人类特殊基因在黄曲霉素的作用下发生突变,维而转变为癌症。黄曲霉素的相对分子质量是 ,156mg黄曲霉素中所含氢元素的质量是 mg。