在整理实验室时,同学发现7瓶不同的无色溶液(见如图所示),其中2、3、7号试剂瓶标签完全破损,4、5号试剂瓶标签部分破损。查阅药品记录单可知,2、3、4、5、7号溶液分别是10% NaOH溶液、饱和石灰水、10% Na2CO3溶液、10% CaCl2溶液、10%稀盐酸中的一种。化学小组同学进行了以下实验探究。
[实验目的]①给试剂瓶贴上正确的标签;②探究部分溶液混合发生的反应。
[查阅资料]①CaCl2溶液呈中性,能与Na2CO3发生复分解反应;
②Ca(OH)2+NaHCO3═CaCO3↓+NaOH+H2O NaOH+NaHCO3═Na2CO3+H2O
[实验探究]
(1)分别取2、3、4、5、7号溶液于5支试管中,向其中分别滴加1号溶液,发现3、4、5号溶液变红色,说明这3种溶液呈 (填“酸性”、“碱性”或“中性”),由该实验可确定的溶液为 (写出试剂瓶编号及相应的溶液名称);
(2)分别取2号5.55g和7号3.65g溶液,混合均匀后,逐滴加入5号溶液。首先观察到有气泡冒出,然后有沉淀析出。加入5号溶液的质量与产生气体或沉淀的质量关系如图1所示,加入5号溶液的质量与溶液pH的变化关系如图2所示。根据图示完成下列问题:
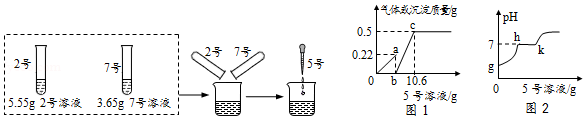
①7号溶液是 (填名称);
②图1中b点数据为 g;
③图2中h→k段发生反应的化学方程式为 。
(3)取3号溶液于试管中,逐滴加入一定量的6号溶液,观察到溶液变浑浊,过滤,则滤液中含有的溶质可能为①NaOH;②Na2CO3;③NaOH、Na2CO3;④NaOH、Ca(OH)2;⑤ 。
[实验反思]分析上述实验,下列说法不正确的是 (填字母序号)。
A.5号试剂可能是部分变质的氢氧化钠溶液
B.该实验无法确定各种试剂,没有完成实验目的①
C.图1中b→c段反应过程中溶液的pH变化情况可用图2中h→k段表示
D.碳酸氢钠既能与碱反应,又能与酸反应
有一包固体粉末,可能含有铜、氧化铁、氯化钠、硫酸钠、硫酸铜中的一种或几种,为确定其成分进行如下实验,现象如图所示(部分生成物未标出):

根据实验过程中的现象判断:
(1)固体B的成分是 (填化学式,下同);a、b、c含同一操作,其名称是 ;
(2)固体粉末中一定不含有的物质是 ,可能含有的物质是 ;
(3)写出反应③的化学方程式 。
化学源于生活,也服务于生活.
(1)近年来,公交车起火事件时有发生,事故发生时,消防员常用高压水枪进行灭火,其原理是 ;起火事件的发生引发了人们对公共交通消防安全问题的重视.乘坐汽车、火车等公共交通工具时.下列物品禁止携带的是 (填序号);
| A. |
衣物 |
B. |
酒精 |
C. |
书刊杂志 |
D. |
鞭炮 |
(2)水是生命之源,净化水的主要操作步骤有沉淀、过滤、杀菌消毒等;硬水给生活和生产带来很多麻烦,生活中常用 方法降低水的硬度;"节约用水,从你我做起",你的一种具体做法是 .
“少一些烟尘,多一片蓝天,建设文明城市,人人有责”
(1)汽车尾气在装有催化剂的净化器中反应的微观过程可用下图表示:

①该反应中没有发生改变的粒子是 ;(填“分子”“原子”或离子”)
②写出上述反应的化学方程式: 。
(2)煤燃烧时产生的二氧化硫是形成酸雨的主要气体之一,可用 来测定雨水的酸碱度,请你提出一条防止酸雨发生的建议: 。
实验室固体氢氧化钠敞口放置在空气中容易变质而失效,现称取该久置于空气中的烧碱样品10.6g完全溶于蒸馏水中配成100g溶液,向其中滴加质量分数为3.7%的氢氧化钙溶液,产生沉淀与所加氢氧化钙溶液的质量关系如图所示。请通过计算回答:
(1)该烧碱样品变质的程度为 (填"部分变质"或"全部变质")。
(2)m= g。
(3)当沉淀刚好达到最大质量时,溶液中溶质质量分数为多少?(写出计算过程,计算结果精确到0.01%)

2017年6月11日,兰州国际马拉松赛如期举行。兴奋剂是国际体育界违禁药物的总称,甲基苯丙胺(C 10H 15N)是兴奋剂的一种,称之为"冰毒",该药小剂量时有短暂的兴奋抗疲劳作用。
(1)甲基苯丙胺中碳、氢、氮的质量比为 。
(2)14.9g甲基苯丙胺中氮元素的质量为 。