工业上,常采用“盐硝联产工艺”生产高纯度食盐,还可以制得硫酸钠。卤水中主要含有NaCl,还含有少量Na2SO4、CaSO4、MgSO4、CaCl2、MgCl2、FeCl3,用火碱和烟道气中的CO2为原料净化卤水,符合低碳经济发展要求。分析流程,回答问题:
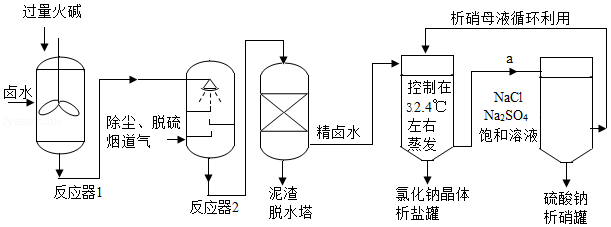
(1)反应器1中主要除去的离子是 (填符号)。
(2)烟道气通入反应器2前要脱硫,是为了除去有害气体 (填化学式)。反应器2中生成沉淀的化学方程式 (写一个)。
(3)下表为NaCl和Na2SO4在不同温度时的溶解度:
温度/℃ |
0 |
10 |
20 |
30 |
32.4 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
溶解度/g |
35.7 |
35.8 |
36.0 |
36.3 |
36.4 |
36.6 |
37.0 |
37.3 |
37.8 |
38.4 |
39.0 |
39.8 |
4.9 |
9.1 |
19.5 |
40.8 |
52.0 |
48.8 |
46.2 |
45.3 |
44.3 |
43.7 |
42.7 |
42.5 |
从析盐罐中排出的溶液a,在温度不变的条件下,每10g水中含有NaCl约 g.为提高Na2SO4纯度,析硝罐中析出Na2SO4,需采用 (填“升温”或“降温”)结晶方法。
某同学配制
质量分数为
的氯化钠时有如下操作,按要求回答问题:
【计算】需要氯化钠固体的质量为
;水的体积为
(水的密度:
);
【称量】用托盘天平称量出所需的氯化钠固体后倒入烧杯中,称量时砝码应放在天平的盘(填"左"或"右");
小明测得石灰石与一定量的稀盐酸反应后的溶液PH为2,也适量该溶液向其中逐滴加入碳酸钠溶液,并测得溶液PH随加入碳酸钠溶液体积的变化曲线如下图所示。
请回答下列问题:
(1)A点处溶液中的两种溶质是(写化学式);
(2)AB段可观察到的实验现象是;
(3)BC段发生反应的化学方程式是;
(4)CD段PH上升的原因是;
请按要求回答下列问题:
(1)用数字和化学符号表示:
1个钠离子; 2个氢氧根离子;3个一氧化碳分子;
(2)如用"O"表示一个氢原子,请用"O"画出下列粒子的微观示意图
2
;
;
化学与我们的生产、生活息息相关。现有以下物质
①食醋 ②Ca3(PO4)2③葡萄糖 ④活性炭 ⑤熟石灰 ⑥维生素A ⑦大理石 ⑧CH4
请选择合适物质的序号填空:
(1)农业上常用作磷肥的是;
(2)能为人体提供能量的物质是;
(3)常用作厨房调味品的是;
(3)常用于改良酸性土地壤的是;
(5)常用作建筑材料的是;
(6)最简单的在机化合物是;
(7)人体缺乏后能导致盲症的是;
(8)常用于冰箱除异味的物质是;
某中学化学兴趣小组在老师的指导下,实验员提供了如下器材和若干化学药品,进行气体的制备和性质的探究,邀请你一同参加.
(1)写出图中标号a仪器的主要用途。
(2)实验室制取少量氢气,且操作相对简易时,发生装置最好选用(填写字母代号),组装好仪器后,应先,再添加药品。
(3)实验室常用过氧化氢溶液制取氧气,该反应的化学方程式是,实验室若要制取干燥的氧气,收集氧气前先将气体通过H装置,H装置中的X是(填"浓盐酸"或"浓硫酸"或"氢氧化钠溶液"),其理由是,气体通过H时应从(填"b"或"c")端进入。