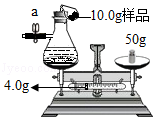
某化学课外活动小组测定长期放置的铁粉中铁单质的百分含量.他们准确称量两份质量各为10.0g的铁粉样品,分别进行如下操作:
(1)如图所示甲同学记录天平砝码和游码的数据为54.0g.将气球中的10.0g铁粉样品加入到盛有过量的稀硫酸的锥形瓶中,反应停止后,天平是否平衡(不考虑空气浮力) (填"是"或"否");要想获取实验的相关数据,后面必须的操作是 (假设气球不破裂且能恢复原状).
| A. |
打开弹簧夹a放出气体 |
B. |
取下砝码 |
| C. |
向右拨动游码至天平平衡 |
D. |
向左拨动游码至天平平衡 |
(2)乙同学把10.0g铁粉样品加入到足量的硫酸铜溶液中,充分反应后过滤、洗涤、干燥、称量,得到固体10.8g,计算该样品中铁单质的百分含量.(写出计算过程)