某化学兴趣小组为探究金属铝和铜的活动性强弱,开展了以下活动。
[查阅资料]
经查阅,金属铝在常温下能与空气中的氧气反应生成致密的氧化铝薄膜。该反应的化学方程式为 。
[对比实验]
编号 |
操作 |
现象 |
甲 |
将表面未打磨的铝丝浸入CuSO4溶液中 |
无明显现象 |
乙 |
将表面打磨后的铝丝浸入CuSO4溶液中 |
铝丝表面析出红色固体 |
丙 |
将表面未打磨的铝丝浸入CuCl2溶液中 |
铝丝表面析出红色固体 |
(1)比较实验乙和实验 (填“甲”或“丙”)可得知:打磨能破坏氧化铝薄膜。
(2)实验乙中反应的化学方程式为 ,据此可知金属活动性Al比Cu (填强”或“弱”)。
(3)小明同学对实验丙的现象进行分析,认为H2O对氧化铝薄膜有破坏作用。但此观点马上被其他同学否定,否定的依据是 。
[猜测与探究]
小组同学针对实验丙的现象,经讨论后猜测:Cl﹣破坏了氧化铝薄膜。
为检验此猜测是否正确,他们首先向两支试管中加入相同的CuSO4溶液,并均浸入表面未打磨的铝丝,然后进行了新的探究:
操作 |
现象 |
结论 |
推论 |
(1)向一支试管中再加入NaCl固体 |
铝丝表面析出红色固体 |
氧化铝薄膜被破坏 |
Na+或① 能破坏氧化铝薄膜 |
(2)向另一支试管中再加入Na2SO4固体 |
② |
氧化铝薄膜未被破坏 |
Na+和SO42﹣都不能破坏氧化铝薄膜 |
[结论与反思]
得出结论:前述猜测 (填“正确”或“不正确”)
总结反思:本次探究充分运用了比较法和控制变量法
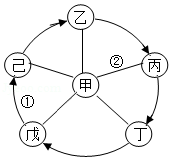
元旦晚会上,物质王国中常见的六种物质甲、乙、丙、丁、戊、己跳起了欢快
的“锅庄舞”。已知丁物质常用作食品干燥剂,己物质是炉具清洁剂中含有的物质。它们的位置关系如图所示,“一”表示物质之间可以反应,“→”表示物质之间可以转化(部分反应物、生成物及反应条件已略去)。回答下列问题:
(1)乙物质的化学式为 。
(2)写出图中序号所对应反应的化学方程式:
① ;
② 。
(3)不慎将己物质的浓溶液沾到皮肤上,应先用大量的水冲洗,再涂上 (填名称)溶液。
(4)上述反应及转化关系中共涉及 种基本反应类型。
已知某水泥样品的主要成分是氧化钙、二氧化硅,并含有一定量的氧化铝、氧化镁等金属氧化物。国家标准实验中测定水泥中钙含量的方法之一是通过高锰酸钾对CaC2O4进行滴定。其流程如图:
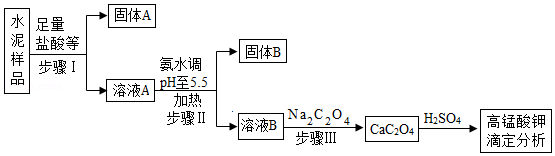
已知:①二氧化硅既不溶于水也不与酸反应。
②氨水显碱性,化学性质与氢氧化钠相似。
(1)pH=5.5的溶液显 (填“酸”、“碱”或“中”)性。
(2)水泥样品中加入盐酸的目的是 。
(3)步骤Ⅰ与步骤Ⅱ中涉及的操作名称是 ,固体A的化学式为 ,固体B中含有物质的化学式为 (任写一个)。
(4)步骤Ⅲ中生成CaC2O4的化学方程式为 。
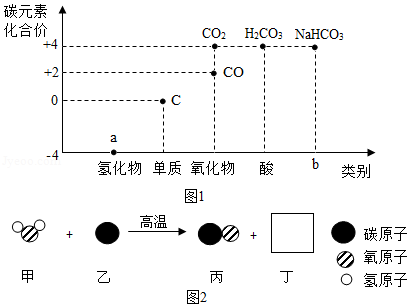
类价二维图反映的是元素的化合价与物质类别之间的关系,构建类价二维图是化学学习的重要方法。图1是某同学绘制的关于碳元素的类价二维图。
(1)a处氢化物为天然气的主要成分,其化学式为 :b处对应物质的类别是 。
(2)煤的主要成分是单质碳。图2是用煤合成水煤气的反应微观示意图。
该反应中方框丁中微粒的图示为 ,甲对应的物质表现出了 性。
(3)类价二维图中的物质在一定条件下可以相互转化。请从含碳物质中选择合适物质完成下列表格:
|
转化类型 |
转化的化学方程式 |
反应用途 |
|
碳元素化合价升高 |
|
工业炼铁 |
|
碳元素化合价不变 |
NaHCO3+HCl=NaCl+CO2↑+H2O |
|
根据所示的实验和提供的数据、图象,回答下列问题:求:
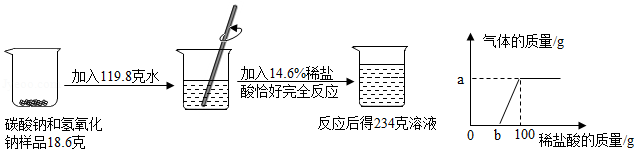
(1)a的质量 g。
(2)b点溶液质量。(写出计算过程)
(3)恰好完全反应后所得溶液中溶质质量分数。(写出计算过程)
由于高铁列车车厢是密闭的空间,因此需要提供清洁的空气和保持车厢的卫生。高铁酸钠(Na2FeOx)是高铁上常用的一种“绿色、环保、高效”的消毒剂。
(1)已知高铁酸钠的相对分子质量为166,则x的值为 。
(2) 克的高铁酸钠中含有4.6克的钠元素。