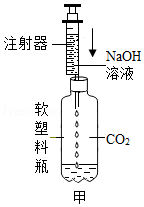
科学探究是学习化学重要而有效的学习方法。某校化学兴趣小组的同学做实验,向盛有少量NaOH溶液的试管中通入CO2,未看到明显的实验现象。同学们对NaOH与CO2能否反应进行验证,并对废液的成分进行探究。
活动一
同学们经过讨论,设计了甲装置并进行实验,请你把实验现象补充完整。
实验步骤 |
实验现象 |
猜测 |
如图甲,向集满二氧化碳的软塑料瓶中滴加足量的氢氧化钠溶液,振荡 |
|
①CO2溶于NaOH溶液中 ②CO2与NaOH反应 |
活动二
兴趣小组的同学对猜测②进行如下探究实验
(1)取软塑料瓶中的液体于三支试管中,三位同学分别完成如图所示实验。
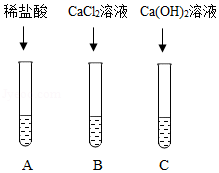
(2)同学们观察到A试管中有气泡冒出,B、C试管中均有白色沉淀生成。请你写出A试管中生成气体的化学反应方程式 。
(3)以上三个实验均能证明CO2与NaOH发生了反应。请写出甲装置中发生反应的化学方程式 。
活动三
实验结束后,同学们将三支试管中反应后的剩余物倒入一个洁净的大烧杯中(如图),充分搅拌、静置,观察到烧杯内上层是无色溶液,下层有白色沉淀。请你分析烧杯上层溶液中一定不含有的离子是 (填离子符号)。小组同学对烧杯内上层溶液中可能含有的离子进行如下探究。
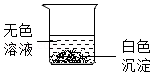
[提出问题]烧杯内上层溶液中可能含有哪些离子?
[猜想与假设]上层溶液中可能含有OH﹣、CO32﹣、Ca2+中的一种或几种。
[进行实验]
实验步骤 |
实验现象 |
实验结论 |
①取烧杯内无色溶液少许于试管中,滴加 滴加过量的氯化钙溶液 ,静置 |
有白色沉淀生成 |
有CO32﹣、无Ca2+ |
②取①中反应后的上层清液少许于试管中,滴加 硫酸铜溶液 (指示剂除外) |
蓝色沉淀生成 |
有OH﹣ |
[反思评价]
(1)经过综合分析,最终确定烧杯内上层溶液中一定存在的离子有 (填离子符号)。
(2)将烧杯内的物质过滤,滤渣回收,向滤液中加入适量的 (填名称)进行处理后再排放,可以有效防止水体污染。