某化学活动小组同学发现,不同物质在发生变化时,即使实验现象相同,其变化的实质也可能存在着本质的区别。
同学们利用如图所示的装置进行了以下两个实验。
实验Ⅰ:在集气瓶底部放入一定量的硝酸铵固体,再将注射器中的水注入瓶中,振荡。
实验Ⅱ:向充满二氧化碳的集气瓶中注入一定量的氢氧化钠溶液,振荡。
[现象分析]上述两个实验过程中,U形管中液面均出现 (填“左高右低”或“左低右高”)现象,其中实验Ⅰ没有发生化学变化,实验Ⅱ发生了化学变化,其反应的化学方程式为 。
[归纳总结]相同的实验现象既可以由物理变化引起,也可以由化学变化引起。
[拓展延伸]在探究白色固体的组成时,也需考虑相同现象是否存在着本质区别。
有一包白色固体,可能含有氧化钙、氢氧化钙、碳酸钙中的一种或几种。为了探究白色固体的成分,同学们做了以下实验。
步骤1:甲同学取一定量的白色固体于试管中,加入一定量的水后振荡,触摸试管外壁,没有感觉到放热现象,说明白色固体中没有 。
试管底部有白色不溶物,甲同学认为白色固体中一定含有碳酸钙,乙同学认为上述现象不足以证明碳酸钙的存在,其理由是 。
步骤2:为进一步得出准确的结论,他们进行了下面所示实验。
实验操作 |
实验现象 |
实验现象 |
(1)将步骤1试管中物质过滤,向滤液中滴加 。 |
溶液由无色 变成红色 |
白色固体中 含有 |
(2)向滤出的固体中加入足量的 。 |
有气泡产生 |

白铜(Cu﹣Ni)是工业上常用的一种合金,金属镍(Ni)的金属活泼性与铁相似,且化合价显+2价。为测定20g某白铜样品中镍的质量,设计了如下实验:

试问:
(1)将白铜研碎的目的是 。
(2)白铜样品中镍的质量 g。
(3)所用稀硫酸中溶质的质量分数(写出计算过程)。
84消毒液是一种无色或者淡黄色具有刺激性气味的含氯消毒剂,有效成分为次氯酸钠(NaClO)。广泛用于医院、宾馆、旅游、家庭等的卫生消毒。某化学兴趣小组对该消毒液进行了如下系列探究。
【查阅资料】
Ⅰ84消毒液不稳定,其杀菌作用主要依靠有效氯,有效氯越高杀菌效果越好。
Ⅱ消毒杀菌就是使病毒蛋白质变性,鸡蛋中蛋白质发生变性反应时变成白色固体。
探究一:84消毒液中有效氯含量的稳定性
0.5%的84消毒液在不同温度、不同存放时间下的有效氯含量:
|
存放时间 (小时) |
不同温度下,有效氯存留率 |
|||
|
60℃ |
70℃ |
80℃ |
90℃ |
|
|
0(对照) |
100% |
100% |
100% |
100% |
|
3.0 |
…… |
…… |
94.66% |
88.05% |
|
6.0 |
…… |
96.66% |
89.67% |
74.69% |
|
12.0 |
…… |
93.32% |
82.62% |
…… |
|
20.0 |
94.75% |
…… |
…… |
…… |
|
20.0 |
92.99% |
…… |
…… |
…… |
【解释与结论】
(1)次氯酸钠(NaClO)中Cl元素的化合价为 。
(2)综合分析探究一中数据,在其他条件不变时,0.5%的84消毒液有效氯存留率受温度和时间的影响,其影响的变化趋势是 ,因此保存84消毒液应注意的问题是 。
探究二:不同浓度84消毒液的杀菌效果
在四只试管中各加入鸡蛋液2mL,分别加入不同浓度的消毒液,静置15分钟后,记录如下:
|
序号 |
2﹣1 |
2﹣2 |
2﹣3 |
2﹣4 |
|
实验操作 |
加入0.5mL消毒原液 |
加入0.5mL清毒 原液,12.5mL水 |
加入0.5mL消毒原液,50mL水 |
加入0.5mL消毒原液,100mL水 |
|
现象 |
液体表面产生气泡,无其他现象 |
液体中产生大量白色固体 |
液体中产生少量白色固体 |
液体中产生极少量白色固体 |
【解释与结论】
(3)探究二中杀菌效果最好的一组实验为 (填序号)。
(4)洁厕灵主要成分是盐酸,与84消毒液混合会产生有毒气体Cl 2,完成反应的化学方程式:2HCl+NaClO═Cl 2↑+H 2O+ 。
某兴趣小组在实验室发现盛有固体氢氧化钠的试剂瓶破裂瓶盖处有"白毛"状物质(如图),根据所学知识,他们推断"白毛"状固体物质中含有碳酸钠,依据是 。他们取5g白色固体,加水配成20g溶液倒入烧杯中,将40g氯化钡溶液分成四等份,分4次加入烧杯中,充分反应后测得数据如下表:
|
实验次数 |
1 |
2 |
3 |
4 |
|
加入氯化钡溶液的质量/g |
10 |
10 |
10 |
10 |
|
烧杯中所得溶液的质量/g |
28.03 |
36.06 |
44.09 |
54.09 |
(1)第 次实验,加入的氯化钡与碳酸钠恰好完全反应。
(2)求5g白色固体中碳酸钠的质量。(写出计算过程,结果保留两位小数)

化学是一门以实验为基础的自然科学。根据所学知识回答以下问题:
(1)实验室制取二氧化碳,应选用以下药品①块状石灰石②碳酸钠粉末③稀盐酸④稀硫酸中的 (填序号)。现有大理石粉末和稀硫酸,你认为 (填“能”或“否”)用于实验室制取二氧化碳。
(2)实验室有如图1装置,根据要求回答问题:
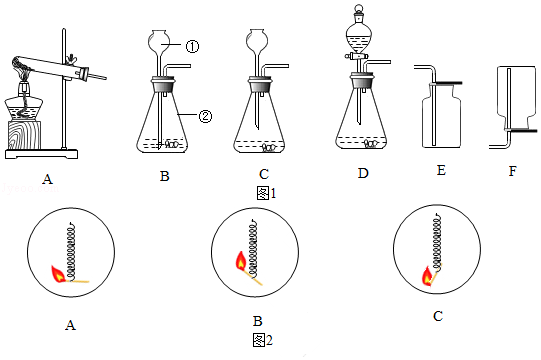
Ⅰ.写出标号仪器的名称① ,② 。
Ⅱ.对比装置B、C,有错误的是 (填序号,下同)。
Ⅲ.实验室要制取二氧化碳应选择的发生装置是 ,收集装置是 ;利用制取二氧化碳的发生和收集装置还能制取另外一种常见气体,利用此装置制取该气体的化学方程式是 。
Ⅳ.图2是同学们进行“铁丝在氧气中燃烧的性质实验”时的几种操作方式,更能提高实验成功率的方式是 (填序号)。
(3)有的同学完成上述实验后,提出“铁丝能否在二氧化碳中燃烧呢?”,他们设计了如下方案:(已知:在点燃的条件下,镁带能在二氧化碳中剧烈燃烧。)
方案①:将弯成螺旋状的细铁丝系上一根火柴,点燃火柴,待火柴快燃尽时,插入装有二氧化碳的集气瓶中,观察铁丝能否被引燃。
方案②:将弯成螺旋状的细铁丝系上一段镁带,点燃镁带,待镁带快燃尽时,插入装有二氧化碳的集气瓶中,观察铁丝能否被引燃。
你认为方案 (填①或②)更为科学,理由是 。
如图为高炉冶铁、炼钢并用生产的钢来探究白铜成分的流程图。(已知硫酸镍的化学式为NiSO 4)

(1)用高炉冶铁的主要反应原理是 (用化学方程式表示)。
(2)分析流程图,三脱装置中发生反应的基本反应类型是 。
(3)向精炼炉中吹入氩气使钢水循环流动,各成分均匀混合,相当于化学实验中 (填一种仪器的名称)的作用。
(4)铁与镍相比,铁的金属活动性 镍(选填">"、"="或"<"),判断依据是 (用化学方程式表示)。
(5)通过以上信息,得出白铜的成分是 ,其硬度比纯铜 (填"大"或"小")。