中国医学著作博大精深,许多化学物质很早就出现在了我国医书中。如李时珍的《本草纲目》中就有绿矾(FeSO4•7H2O)的相关记载。绿矾又名皂矾、青矾,性酸、凉、无毒,主要药用功能是除湿、解毒、收敛、止血。
(1)请写出铁与稀硫酸反应的方程式 。
(2)某实验小组欲用久置的硫酸亚铁溶液制备绿矾(FeSO4•7H2O)晶体,小明同学提出该硫酸亚铁溶液可能变质了,于是进行了以下探究活动:
[查阅资料]
①FeSO4易被空气中的氧气氧化成Fe2(SO4)3而变质。
②Fe2+在溶液中呈浅绿色,Fe3+在溶液中呈黄色。
③Fe3+的检验:向含Fe3+的溶液中滴加无色的KSCN(硫氰化钾)溶液,溶液会变为血红色。
[猜想与假设]猜想1:该硫酸亚铁溶液没有变质。
猜想Ⅱ:该硫酸亚铁溶液已经变质。
[设计实验并验证]
实验操作步骤 |
实验现象 |
实验结论 |
取少量样品于试管中,加入2﹣3滴 溶液 |
试管中溶液变成血红色 |
|
[实验拓展1]下列各组物质在溶液中能大量共存,且形成无色溶液的是 。
A.CuSO4、NH4Cl、Ba(OH)2
B.FeSO4、Na2SO4、KCl
C.FeCl3、NaOH、HCl
D.NaCl、MgSO4、KNO3
[实验拓展2]该实验小组继续查阅资料得知,单质铁能与硫酸铁溶液反应生成硫酸亚铁。于是向上述久置的硫酸亚铁溶液中加入过量铁粉,写出其中的化学方程式 。
根据如图所示装置回答下列有关问题:

(1)仪器x的名称是 ;
(2)若用装置B收集氧气,进气口应为 端(选填“a”或“b”);
(3)对比装置C和D,可以得出关于可燃物燃烧的条件是 ;
(4)某同学连接A、E、F进行实验,A中所加药品不同,F中所加药品相同.
①若实验时E中蜡烛熄灭,F中溶液变浑浊,则E中现象说明A中产生的气体所具有的性质是 ;
②若实验时E中蜡烛燃烧更旺,F中溶液变浑浊,则A中反应的化学方程式为 .
某化学课外活动小组测定长期放置的铁粉中铁单质的百分含量.他们准确称量两份质量各为10.0g的铁粉样品,分别进行如下操作:
(1)如图所示甲同学记录天平砝码和游码的数据为54.0g.将气球中的10.0g铁粉样品加入到盛有过量的稀硫酸的锥形瓶中,反应停止后,天平是否平衡(不考虑空气浮力) (填“是”或“否”);要想获取实验的相关数据,后面必须的操作是 (假设气球不破裂且能恢复原状).
A、打开弹簧夹a放出气体 B、取下砝码
C、向右拨动游码至天平平衡 D、向左拨动游码至天平平衡
(2)乙同学把10.0g铁粉样品加入到足量的硫酸铜溶液中,充分反应后过滤、洗涤、干燥、称量,得到固体10.8g,计算该样品中铁单质的百分含量.(写出计算过程)

我国制碱工业先驱侯德榜先生发明了将制碱与制氨结合起来的联合制碱法,大大提高了原料利用率.其模拟流程如下:

(1)反应 ①的化学方程式是 .
(2)反应 ②的化学方程式是 .
(3)操作a的名称是 .
4Cl可用作农业生产的氮肥,铵态氮肥常用 检验.
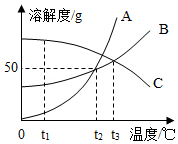
A、B、C三种固体物质的溶解度曲线如图所示,回答下列问题.
1℃时,A、B、C三种物质的溶解度由大到小的顺序是 .
2℃时,在A物质的饱和溶液中溶质与溶剂的质量最简比为 .
3℃时,100g水中溶解60g B刚好饱和,那么50g 水中溶解 g C也刚好达饱和.
(4)当A中混有少量B时,可用 (填“降温结晶”或“蒸发结晶”)方法提纯A.
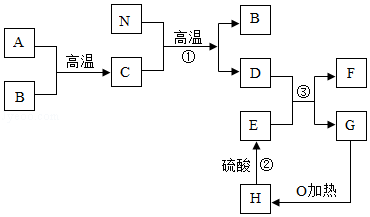
如图中各物质均为初中化学常见物质,其中A为黑色非金属单质,D、G为金属单质且G为紫红色,B是导致温室效应的主要气体,C是一种有毒气体,反应 ①是炼铁工业中的主要反应,它们之间的相互转化关系如图所示:
(1)反应①的化学方程式是 。
(2)反应②的化学方程式是 。
(3)F物质的化学式是 。
(4)在②中若加入的硫酸过量,则在反应③中还会产生一种非金属单质是 。