已知:Na2O为白色,Na2O2为淡黄色;Na2O+H2O=2NaOH.某兴趣小组对钠和铜的单质及其化合物的性质进行了如下实验探究。
①将铜片置于铁架台的铁圈上,用酒精灯加热,观察到铜片表面变黑;
②趁热将钠置于铜片表面,钠剧烈燃烧,有淡黄色物质生成,将此淡黄色物质转移到试管中待用,再用蒸馏水冲洗铜片,观察到铜片上钠燃烧处出现了光亮的铜斑;
③向盛装淡黄色物质的试管中滴加蒸馏水,观察到冒气泡,将带火星的木条伸入试管,木条复燃。
回答下列问题:
(1)步骤①产生的黑色物质是 ,步骤②淡黄色产物中氧元素的化合价为 价。
(2)步骤②中产生铜斑反应的另一产物,进一步与氧气反应也转化为淡黄色物质,则产生铜斑反应的化学方程式为 。
(3)步骤③产生的气体物质为 。
(4)猜想步骤③还可能有一种常见物质 (填化学式)生成,向反应后的溶液中滴加 溶液(可供选择的试剂:H2SO4、CuSO4、KOH、Na2CO3),观察到 的现象时,即证明了你的猜想。
在学习“酸和碱”后,瑞娟同学对“硫在氧气中燃烧”实验进行再探究。想到实验生成的二氧化硫是非金属氧化物,提出疑问:二氧化硫能否与水反应生成酸?
为此,瑞娟同学做了如下实验:将点燃的硫伸入盛有氧气的集气瓶(有少量的水)中,反应中产生刺激性气味的气体;反应后,盖紧集气瓶口的玻璃片,振荡集气瓶;再打开玻璃片,仍能闻到刺激性气味;随后向其中滴入几滴紫色的石蕊试液,瓶中液体变为红色。
瑞娟同学产生许多困惑:这种能使石蕊试液变红色的物质是什么?怎样防止二氧化硫排放到空气中去?
瑞娟询问老师,老师告知:在涉及的反应中,二氧化硫与二氧化碳的性质相似;二氧化硫与水反应生成“亚硫酸”(化学式为H2SO3);亚硫酸还可进一步与氧气反应生成硫酸。
请你帮助瑞娟同学解答下列问题:
(1)请结合如图图示中所给实验用品,设计一个实验用来验证:二氧化硫不能使石蕊变红色。

实验操作: 。
(2)分别写出生成亚硫酸、硫酸的两个化学方程式:① ;② 。
(3)以上两个化学反应都属于 反应(填基本反应类型);亚硫酸中硫元素的化合价为 价。
(4)亚硫酸、硫酸、盐酸和碳酸都能使石蕊试液变红色,从微观角度分析原因是 ;
(5)为更多的吸收二氧化硫,防止二氧化硫散发至空气中。有以下试剂,你认为用来代替集气瓶中的水最为合适的是 (填序号)。
①饱和氢氧化钙溶液; ②饱和氯化钠溶液; ③浓盐酸; ④饱和氢氧化钠溶液

实验室中分别用高锰酸钾、过氧化氢、氯酸钾制取比较纯净的氧气。请你按照要求回答问题:
(1)结合下图所提供装置完成下列表格
|
填写内容/反应物 |
化学方程式 |
气体制取装置组合(填序号) |
|
高锰酸钾 |
例:2KMnO4 |
|
|
过氧化氢(二氧化锰) |
|
|
|
氯酸钾(二氧化锰) |
|
/ |
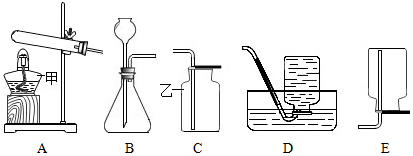
(2)请结合图回答问题:
①写出甲、乙所指仪器名称:甲 ;乙 ;
②用过氧化氢制氧气的装置与其他两种方法的装置相比具有的优点: , (写出两条);
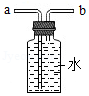
③若用如图装置收集一瓶氧气,气体应从 (填a或b)端进入集气瓶。
镁在国产大飞机C﹣919”的制造中大显身手,小亮在实验室模拟“海水制镁”的原理来富集镁,他将25g氯化钠和氯化镁的固体混合物全部溶解于盛有70g水的烧杯中,然后向其中加入63.6g氢氧化钠溶液至恰好完全反应(图象如图),过滤,称量滤液质量为147g,求:
(1)图象中m= g。
(2)滤液中溶质的质量分数是多少?

造纸是我国古代四大发明之一,它极大地推动了人类文明的发展。
(1)践行“习近平生态文明思想”,应积极推广垃圾分类和回收利用。旧报纸应投放到贴有如图 (填字母)标签的垃圾筒内。

6105n,n为正整数]中H、O两种元素的质量比为 (用最简整数比表示)。
(3)造纸会产生大量含NaOH的废水,需处理至中性后排放。环保监测小组取某造纸厂废水样品过滤,为测定滤液中NaOH的质量分数,进行了如下实验:
步骤1:取20.0g滤液于锥形瓶中,滴入几滴酚酞溶液。
步骤2:向锥形瓶中逐滴滴加溶质质量分数为10.0%的硫酸溶液至溶液呈中性,此时溶液呈 色。消耗硫酸溶液3.92g。
计算废水滤液中NaOH的质量分数。(请写出计算过程)
2017年12月18日,南通地铁正式开建,标志着南通进入“地铁时代”。

(1)地铁列车车体大量使用的镁铝合金属于 (填“金属材料”或“合成材料”),镁铝合金的优点是 。
(2)地铁建造过程中需要使用大量的钢铁。工业炼铁可利用一氧化碳与氧化铁反应,写出该反应的化学方程式: 。
2)和晶体硅(Si)。将二氧化硅转化为硅的过程属于 (填“物理变化”或“化学变化”)。
(4)地铁施工过程中产生的废水、废浆以及机械漏油等,都会对水体产生污染。使用活性炭可对污水进行处理,这是利用了活性炭的 性。
(5)为确保消防安全,地铁隧道中须安装自动喷淋系统。喷出的水能灭火的原因是 。
(6)地铁施工工程车的尾气中含NO、CO.尾气经过如图2所示催化转化后,可实现达标排放。写出单质X的化学式: 。