某兴趣小组对氢氧化钡溶液和稀盐酸混合后是否发生了化学反应展开了系列实验。
【实验操作】
用试管取6毫升氢氧化钡溶液,往试管中加入6毫升稀盐酸,等分成两份。
【实验证明】
(1)往其中一份混合液中滴入几滴酚酞试液,发现溶液呈无色。说明溶液中不存在的离子是 ,证明两者发生了反应。
【继续探究】
(2)能否再设计一个实验证明盐酸中H+参加了反应?于是往混合液中滴入石蕊试液,发现变红色,溶液呈酸性,这不能证明盐酸中H+参加了反应。讨论后,形成了新的对照实验方案,将步骤补充完整:
①往盛有另一份混合液的试管中,加入足量的镁片;
② ,加入等量的镁片。
(3)证明原混合液的盐酸中H+参加了反应的现象是 。
【微观解释】
(4)从微观上分析:氢氧化钡溶液和稀盐酸反应的实质是 。

以下是实验室常用的部分仪器。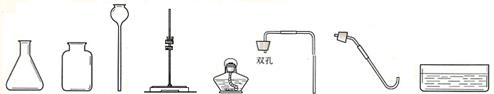
① ② ③④ ⑤ ⑥ ⑦ ⑧
(1)仪器③的名称是 ;
(2)用过氧化氢溶液和二氧化锰混合物制氧气时,选用的发生装置是 ,反应的化学方程式为 。要收集0.64g氧气,需要H2O2的质量是 g
(3)同学们用浓盐酸和块状石灰石反应制取二氧化碳,并将得到的气体通入澄清石灰水中,始终没有发现澄清石灰水变浑浊。小英认为澄清石灰水已经变质;小青认为得到的CO2中混有 气体。他们为了证明自己的猜想进行了如下实验:
①小英将气体通入到新制的澄清石灰水中,但仍未发现澄清的石灰水变浑浊;
②小青取 与块状石灰石反应制取的CO2,并将产生的气体通入原澄清石灰水中,变浑浊,请写出石灰水变浑浊的化学方程式 。
(4)乙炔是一种无色、无味、难溶水的气体,密度和空气接近,收集乙炔气体可选用的装置是 。
实验室久盛石灰水的试剂瓶内壁常附有一层白色污渍,此污渍 (填“能”或“不能”)用水洗掉,写出清除此污渍的反应的化学方程式 。
回答下列问题:
(1)碳的单质有多种,具有下列结构的碳单质中,物理性质差异大的原因 。
(2)上海世博会体现的“低碳”亮点主要是降低了 气体的排放。
(3)CO和CO2都是碳的氧化物,但由于它们的 不同,导致化学性质不同。
请用“守恒”思想回答下列问题
(1)“嫦娥三号”成功发射升空.火箭燃料偏二甲肼(C2H8N2)和四氧化二氮(N2O4)发生反应的化学方程式为C2 H8N2+2N2O4=3X+2CO2+4H2O,则X的化学式为 ;
(2)R在氧气中燃烧的表达式为R+O2 H2O+CO2而且已知4.6gR和一定量的氧气反应,生成8.8gCO2和5.4gH2O,则参加反应的R的元素组成 ,得出结论的依据 。
H2O+CO2而且已知4.6gR和一定量的氧气反应,生成8.8gCO2和5.4gH2O,则参加反应的R的元素组成 ,得出结论的依据 。
有下列物质①氢气 ②铜丝 ③二氧化硫 ④液氧 ⑤澄清石灰水 ⑥空气 ⑦水,其中属于混合物的是 ;(填序号,下同)属于化合物的是 ;由原子直接构成的是 ;属于氧化物的是 。