有一包白色固体样品,可能含氢氧化钠、硝酸钠、碳酸钠、硫酸钠、氯化钡中的一种或几种。小金同学为探究其成分完成了以下实验:
①取少量白色固体溶于水,得到无色溶液,等分为两份;
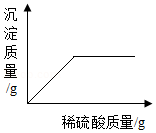
②往一份无色溶液中加入稀硫酸,产生沉淀质量与所加稀硫酸质量关系如图所示;
③往另一份无色溶液中通入适量的CO2,产生白色沉淀。
请回答:
(1)仅根据②推测原样品中一定不存在的物质是 ;
(2)原样品的所有可能组成是 。
用正确的化学符号填空。
(1) 1个铜原子;(2) 2个氮分子;
(3) 3个铵根离子;(4)一种红褐色的固体;
(5)碳酸钠中碳元素的化合价;(6)澄清石灰水中的溶质。
化学与人类生活密切相关,请用所学知识回答下列的问题。
(1)下列服装主要用天然材料制成的是_____________。(填标号)
| A.羊毛衫 | B.涤纶连衣裙 | C.腈纶运动衣 | D.纯棉T恤 |
(2)生石灰常用于食品干燥剂,生石灰与水反应的化学方程式为;
厨房里燃烧天然气来煮熟食物,天然气完全燃烧的化学方程式。
(3)良好的家居环境带来美好的生活。房屋装修后,可在室内放一些活性炭来吸收装修材料释放出的
甲醛、苯等有毒气体,这是利用活性炭的性。
(4)2012年12月26日京广高铁全线运营。建高铁需要大量的钢铁,工业上用氧化铁炼铁的化学方
程式为。车体用铝合金材料而不用纯铝的原因是。
(5)实验室常用酒精灯加热物体,其中酒精燃烧的化学方程式____________________;
(6)常温下固体硫化亚铁(FeS)和稀硫酸生成硫化氢(H2S)气体和硫酸亚铁,实验室常用该反应制取硫化氢气体,写出该反应的化学方程式_________________________;硫化氢(H2S)是一种无色、有臭鸡蛋气味的有毒气体,其水溶液叫氢硫酸,具有挥发性。根据上述信息实验室选用右图装置收集硫化氢气体,其中b装置的作用是______________________________。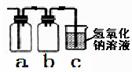
)用化学用语回答下列问题:
(1)2个氮分子________ (2)氨水中的阴离子的符号______;(3) 硫酸铁中硫元素的化合价_______;
(4) 实验室用高锰酸钾制取氧气_________________________________;
(5) 除去硫酸钠中的少量碳酸氢钠__________________________________。
近几年我国不少水域多次发生严重的“赤潮”、“水华”现象。“赤潮”、“水华”主要是指水中某些植物营养元素含量过高、导致水面上的藻类疯狂生长、繁殖,水质恶化,造成鱼类死亡。
(1)已知藻类的化学式为C106H263O110N16P,则组成藻类的元素有,藻类的相对分子质量为,该藻类中氮元素的质量分数是。
(2)根据藻类的化学式确定,工业和生活污水中导致藻类生长过快的营养元素是。
(3)为了解决水体污染,应从控制污染源头着手。下列措施能防止“赤潮”、“水华”现象发生的是(填序号)。
①在水域沿岸新建的住宅小区、饭店、宾馆采用生活污水净化装置;
②两岸居民禁止使用含磷酸钠的洗衣粉;
③禁止用该水域的水进行农业灌溉;
④向该水域中加入大量的净水剂和消毒剂。
(4)“水华”现象一般发生在枯水期还是汛期?为什么?
现要制取一些二氧化氮气体来做演示分子运动的实验。已知二氧化氮气体可以通过铜和浓硝酸反应Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O得到。二氧化氮是一种红棕色的气体,密度比空气大,能和水反应生成HNO3和NO气体,NO和NO2都是大气污染物。现给出下列装置(A~F): 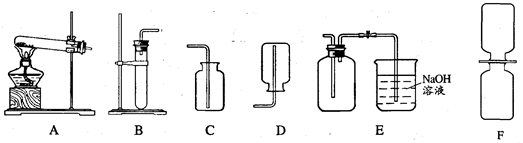
(1)写出二氧化氮和水反应的化学方程式______________________________________;
(2)制二氧化氮的发生装置可以选__________,收集二氧化氮的装置应该选_________;
(3)要得到干燥的二氧化氮可将其通过________________; E装置中NaOH溶液的作用是。
(4)NO一遇到O2就会变成NO2,收集NO应用__________法;
(5)用如上图F装置演示分子运动时,为了缩短演示的时间,NO2最好放在__________(选填“上”或“下”)面的集气瓶中,另一瓶是空气,抽去两瓶之间的玻璃片,可以看到________________________________________________________________。