金属材料的应用推动了社会的发展。新型材料的研制,已成为现代高新技术的重要物质基础。
(1)目前常用的1元硬币为钢芯镀镍合金,具有耐腐蚀、 等优点。
(2)镁和铝可熔炼成Mg17Al12镁合金,熔炼过程只能在真空中,不能在空气中进行的原因是 (写其中一个化学方程式)。
(3)某废弃物中可能含有Cu、CuO、Mg、Zn中的一种或几种,为确定其成分并回收金属,取样品进行如图实验。
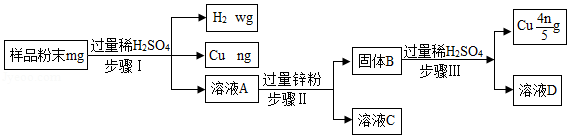
①步骤Ⅱ的操作是 。
②步骤Ⅱ中产生的现象是 。步骤Ⅲ中锌和稀硫酸反应的化学方程式为 。
③若溶液C中只含一种溶质,则样品的成分是 。
④通过测氢气的质量,也可确定样品的成分,则w的值为 (用m和n的代数式表示)。
燃料的使用,给我们的生活带来了便利。煤、石油和天然气是重要的化石能源,写出天然气中最主要成分在空气中燃烧的化学方程式 ;目前化石燃料面临被耗尽的危险,人们正在利用和开发许多其他能源,请你列举几种常见的其他能源(列出3种以上) 。
垃圾分类回收是一项重要工作。习近平总书记对垃圾分类作出重要指示“培养垃圾分类的好习惯,为改善生活环境作努力,为绿色可持续发展作贡献”。请你结合学过的知识,回答下列问题。
(1)如图标志表示 。
(2)请你谈谈垃圾分类回收的意义。

为测定某氧化铜和铜的固体混合物中氧化铜的质量分数,小勇同学取20g固体混合物置于烧杯中,将100g稀硫酸分为四等份依次加入其中进行实验,测得数据如下:
|
次序 |
① |
② |
③ |
④ |
|
加入稀硫酸的质量/g |
25 |
25 |
25 |
25 |
|
剩余固体的质量/g |
16 |
a |
10 |
10 |
回答列问题:
(1)原固体混合物中,氧化铜的质量分数为 。
(2)上表中,a的值为 ,实验③所得溶液中的溶质是 (填化学式)。
(3)计算该实验所用稀硫酸中溶质的质量分数。(写出计算过程,结果精确到0.1%)
某化学兴趣小组为探究金属铝和铜的活动性强弱,开展了以下活动。
[查阅资料]
经查阅,金属铝在常温下能与空气中的氧气反应生成致密的氧化铝薄膜。该反应的化学方程式为 。
[对比实验]
|
编号 |
操作 |
现象 |
|
甲 |
将表面未打磨的铝丝浸入CuSO4溶液中 |
无明显现象 |
|
乙 |
将表面打磨后的铝丝浸入CuSO4溶液中 |
铝丝表面析出红色固体 |
|
丙 |
将表面未打磨的铝丝浸入CuCl2溶液中 |
铝丝表面析出红色固体 |
(1)比较实验乙和实验 (填“甲”或“丙”)可得知:打磨能破坏氧化铝薄膜。
(2)实验乙中反应的化学方程式为 ,据此可知金属活动性Al比Cu (填强”或“弱”)。
(3)小明同学对实验丙的现象进行分析,认为H2O对氧化铝薄膜有破坏作用。但此观点马上被其他同学否定,否定的依据是 。
[猜测与探究]
小组同学针对实验丙的现象,经讨论后猜测:Cl﹣破坏了氧化铝薄膜。
为检验此猜测是否正确,他们首先向两支试管中加入相同的CuSO4溶液,并均浸入表面未打磨的铝丝,然后进行了新的探究:
|
操作 |
现象 |
结论 |
推论 |
|
(1)向一支试管中再加入NaCl固体 |
铝丝表面析出红色固体 |
氧化铝薄膜被破坏 |
Na+或① 能破坏氧化铝薄膜 |
|
(2)向另一支试管中再加入Na2SO4固体 |
② |
氧化铝薄膜未被破坏 |
Na+和SO42﹣都不能破坏氧化铝薄膜 |
[结论与反思]
得出结论:前述猜测 (填“正确”或“不正确”)
总结反思:本次探究充分运用了比较法和控制变量法
实验室利用如图所示装置进行相关实验。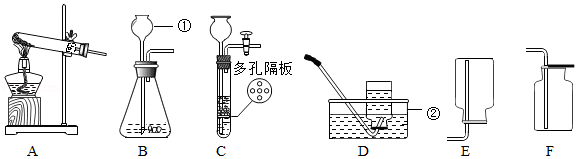
回答下列问题:
(1)写出装置图中标号仪器的名称:① ,② 。
(2)用高锰酸钾制氧气,应选用的发生装置是 (填字母序号),该反应的化学方程式为 ,其中转化为氧气的氧元素与高锰酸钾中氧元素的质量之比是 。
(3)常温下,用锌和稀硫酸反应制取氢气,若要随时控制反应的发生和停止,应选用的发生装置是 (填字母序号),反应的化学方程式为 ;点燃氢气前必须验纯,为确保安全,最好选用装置 (填字母序号)所示方法收集氢气。