H2SO4是一种重要的化工原料。
(1)H2SO4溶液的pH 7(填“>”、“<”或“=”),请写出用pH试纸测定稀硫酸pH的正确方法 ;
(2)浓硫酸有吸水性,常用作某些气体的干燥剂,下列气体不能用浓硫酸干燥的是 (填写序号);
①H2
②CO2
③NH3
④HCl
(3)实验室常用亚硫酸钠固体(Na2SO3)和70%左右的硫酸溶液发生复分解反应制取SO2,请写出该反应的化学方程式: ;
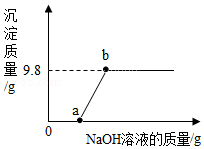
(4)向160g含有H2SO4和CuSO4的混合溶液中逐滴加入NaOH溶液至过量,产生的沉淀质量与加入NaOH溶液质量的关系如图所示,请写出b点对应溶液的溶质 (填写化学式),原混合溶液中CuSO4的质量分数是 。
化学就在我们身边,请回答下列问题。
(1)玉米中富含的基本营养素是 。在种植玉米的过程中常施用铵态氮肥,铵态氮肥不能与碱性物质混合施用,是因为其能与碱性物质发生反应,生成 ,逸散到空气中,降低肥效。
(2)生活中鉴别羊毛纤维和棉纤维的方法是 。
(3)金刚石和石墨都是由碳元素组成的单质,但物理性质却存在很大差异,其原因是 。
(4)车用乙醇汽油可适当节省石油资源,并能在一定程度上减少汽车尾气的污染。请写出乙醇燃烧的化学方程式 。
某化验室用20%的氢氧化钠溶液洗涤一定量工业产品中残余的H2SO4(工业产品及其他杂质都不与氢氧化钠溶液反应),当恰好完全反应时,共消耗氢氧化钠溶液80g,求产品中残余的H2SO4质量和生成硫酸钠的质量。
在化学反应中,由于参加化学反应物质的质量不同,产物可能有所不同。
[已有知识]碳与氧气发生化学反应,当氧气充足时,产物是 ;当氧气不充足时,则能产生有毒气体 。
[查阅资料]澄清石灰水与碳酸氢钠溶液反应时,由于参加化学反应的物质化学计量数之比不同,生成的产物可能不同。请完成下列空格中的化学方程式。
|
Ca(OH) 2与NaHCO 3化学计量数之比 |
产物 |
化学反应方程式 |
|
|
反应一 |
1:1 |
CaCO 3、NaOH、H 2O |
Ca(OH) 2+NaHCO 3═CaCO 3↓+NaOH+H 2O |
|
反应二 |
1:2 |
CaCO 3、Na 2CO 3、H 2O |
Ca(OH) 2+2NaHCO 3═CaCO 3↓+Na 2CO 3+2H 2O |
|
反应三 |
1:1.5 |
CaCO 3、NaOH、Na 2CO 3、H 2O |
|
[产物探究]某兴趣小组在老师的指导下欲对上述反应三得到的相关产物进行探究,请帮助完成下列问题。
可选试剂:稀盐酸、Ba(OH) 2溶液、BaCl 2溶液、无色酚酞溶液。
信息资料:BaCl 2溶液呈中性、碳酸钡为白色不溶物。
|
实验步骤 |
实验现象 |
实验结论 |
|
步骤l:将Ca(OH) 2与NaHCO 3按化学计量数1:1.5 混合,在水溶液中使其充分反应 |
产生白色沉淀 |
产物中有碳酸钙 |
|
步骤2:将步骤1所得混合物静置,取少量上层清液于试管中,向其中加入 。 |
|
产物中有碳酸钠 |
|
步骤3:将步骤2所得混合物静置,取少量上层清液于试管中,向其中滴加 。 |
|
产物中有氢氧化钠 |
[深入思考]有的同学认为在上述步骤2中也可以加入氯化钙溶液来证明产物中有碳酸钠,请说出你的观点并解释: 。
如图是实验室常用来制取气体的实验装置,请根据要求回答下列问题:

(1)仪器a的名称是 。
(2)实验室用氯酸钾和二氧化锰制氧气,选择的发生装置是 ,选择E装置收集氧气,因为氧气不与水反应,并且 ,应将收集满氧气的集气瓶 (填“正”或“倒”)放在桌面上,实验结束后,先将导管撤离水槽,再 。
(3)若选择B装置制取氧气,发生反应的化学方程式为 。
(4)实验室制取二氧化碳选用的发生装置是 ,选择的收集装置是 ,验证生成的气体是二氧化碳的化学方程式为 。
如图A~E是初中化学中五种常见的物质,各物质的转化关系如图所示。已知A俗称苏打,D是人体胃液中主要含有的酸,E可以用来配制波尔多液。其中图中的“﹣”表示相连两物质之间能发生反应,“→”表示一种物质能转化成另一种物质(部分反应物、生成物、反应条件已略去)。根据图示回答下列问题:
(1)E除了能配制波尔多液,还可以用来 。
(2)写出图示中符合下列要求的化学反应方程式:
①A→B的反应: 。
②C与D的反应: 。
③A与E的反应: 。