化学与人类生活息息相关。请回答下列问题。
(1)化石燃料燃烧产生大量CO2,加剧了大气层的 效应。
(2)油锅起火可盖上锅盖使火熄灭,其灭火原理是 。
(3)大米中含有的糖类物质主要是 (填名称)。
(4)儿童患佝偻病、骨骼疏松是因为缺少 元素。
(5)用铁制作炊具是利用其良好的延展性和 性。
根据表中NaCl和KNO3部分溶解度数据分析,回答下列问题:
|
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
|
溶解度/g |
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
|
KNO3 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
|
(1)30℃时,NaCl的溶解度是 g.
(2)NaCl与KNO3相比较,溶解度受温度变化影响较小的物质是 .
(3)20℃时,在100g水中加入50gNaCl或50gKNO3,充分搅拌后,将溶液温度升高到40℃(不考虑水分蒸发),所得溶液是不饱和溶液,则加入的物质是 .
“宏观现象一微观结构﹣符号表征”是学习化学的思维方法。如图表示在催化剂作用下,将汽车尾气中的一氧化碳、二氧化氮转化为无害气体的反应原理。

(1)用化学符号表示5个二氧化氮分子 。
(2)如图所示反应物和生成物中属于单质的是 (填化学式)。
(3)如图所示的化学反应方程式为 。
金属和金属材料在日常生活中有广泛用途.请回答下列问题:
(1)地壳中含量最高的金属元素是 (填元素符号).
(2)现有甲、乙、丙三种金属,如果把甲和乙分别放入稀硫酸中,甲溶解并产生氢气,乙不反应;如果把乙和丙分别放入硝酸银溶液中,过一会儿,在乙表面有银析出,而丙没有变化.根据以上实验事实,判断甲、乙、丙的金属活动性由强到弱的顺序是 .
(3)铜丝浸入硝酸银溶液中,可发生反应:Cu+2AgNO3=Cu( NO3)2+2Ag,该反应属于四种基本反应类型中的 反应.
某种矿石由氧化镁、氧化铁、氧化铜和二氧化硅组成,用它制备氢氧化镁的流程示意图如图所示(已知:二氧化硅不溶于水也不与稀盐酸反应)。
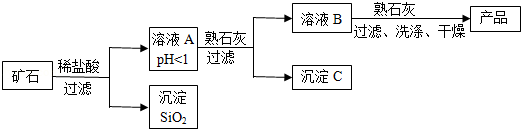
请回答下列问题:
(1)溶液A中共含有 种阳离子;写出矿石中的任意一种金属氧化物与稀盐酸反应的化学方程式 (只写一个)
(2)在溶液A中加入熟石灰调节溶液的pH,可以使溶液中的金属阳离子转化为沉淀,该实验条件下,使金属阳离子沉淀的相关pH数据见表。为保证产品纯度、减少产品损失,并便于操作,溶液B的pH可允许的范围为是 ;
|
氢氧化物 |
Fe(OH)3 |
Cu(OH)2 |
Mg(OH)2 |
|
开始沉淀的pH |
1.5 |
4.2 |
8.6 |
|
完全沉淀的pH |
3.2 |
6.7 |
11.1 |
(3)写出溶液B中加入熟石灰发生的化学反应方程式 。
某品牌矿泉水的标签上标明的矿泉水主要成分如下表所示,请根据本表回答下列问题:
|
水质主要成分(mg/L) |
|
|
偏硅酸(H2SiO3) 28.9﹣42.9 碳酸氢根(HCO 氯离子(Cl﹣) 1.0﹣8.0 硫酸根(SO42﹣) 16.06﹣19.52 镁 2.5﹣7.5 |
锶(Sr) 0.01﹣0.32 钙 5﹣45 钠(Na+)45﹣70 钾(K+) 0.5﹣2.0 PH 7.8±0.5 |
①碳酸氢钙的化学式是 。
②二个镁离子的化学符号是 。
③用结构示意图表示Cl﹣的核外电子排布 。
④请在偏硅酸化学式中标记硅元素的化合价 。
⑤矿泉水属于 (填“纯净物”或“混合物”)。
⑥淡水资源有限,我们需要节约用水,如图中表示节水标志的是 