酸碱中和反应是初中阶段重要的一类反应,请你一起参与探究。
【实验探究Ⅰ】在50mL一定浓度的氢氧化钠溶液中滴加50mL一定浓度的盐酸,并用玻璃棒搅拌,观察到溶液的温度 ,由此现象小李同学得出两者能发生反应的结论。通过查阅相关资料后,小张同学发现此结论不够严谨,设计了下列3个对比实验:
①50mL一定浓度的盐酸与50mL蒸馏水混合,测量溶液温度的变化。
②50mL一定浓度的氢氧化钠溶液与50mL蒸馏水混合,测量溶液温度的变化。
③50mL一定浓度的盐酸与50mL一定浓度的氢氧化钠溶液混合,测量溶液温度的变化。
用数字化实验技术测得3个实验,溶液温度随时间变化的关系如图所示。
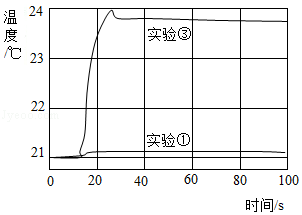
(1)由图可知,盐酸、氢氧化钠溶液稀释时均 (填“放热”或“吸热”),但它们稀释时温度的变化量远 两溶液混合时温度的变化量。
(2)从微观角度分析,此中和反应的温度变化主要是由于 (填离子符号)两种离子发生反应放出热量的缘故。
[实验探究Ⅱ]
(1)在50mL一定浓度的氢氧化钠溶液中滴加2~3滴酚酞试液,再逐滴加入一定浓度的盐酸,并用玻璃棒搅拌,溶液颜色由红色刚好变为无色时,可说明两者发生了反应。该反应的化学方程式为 。
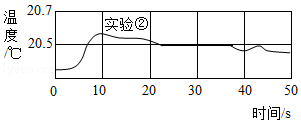
(2)取一定量反应后的无色溶液加热蒸发,在蒸发的过程中,“意外”发现溶液由无色又变成红色。同学们对红色溶液中溶质的成分(酚酞除外)进行再探究。
查阅资料:酚酞在pH<8.2的溶液中呈无色,在8.2<pH<14的溶液中呈红色。
作出猜想:猜想一:NaCl
猜想二:NaCl、NaOH
猜想三:NaCl、NaOH和Na2CO3
同学们讨论后一致认为猜想 是错误的,理由是 。
实验验证:取样,滴加 ,无气泡产生,猜想三错误。
原因分析:反应后无色溶液中仍存在少量NaOH,加热蒸发,当溶液的pH在 范围内,溶液的颜色变红。
总结反思:向某碱性溶液中滴加2~3滴无色酚酞试液,振荡后溶液的颜色 (填“一定”或“不一定”)变红。
某白色固体由BaSO4、BaCO3、Na2CO3、Ba(OH)2中的三种物质组成。为确定其成分,某同学设计并完成如下实验,请把表格中的内容补充完整。(已知:BaSO4不溶于稀盐酸)

|
序号 |
Ⅰ |
Ⅱ |
Ⅲ |
|
操作 |
|
|
|
|
现象 |
有气泡产生,固体有剩余 |
有气泡产生 |
产生白色沉淀,溶液最终显 色 |
|
结论或解释 |
原白色固体中含有
|
原白色固体中含有Na2CO3:生成气体的化学方程式为
|
原白色固体中含有BaCO3. |
实验室常用大理石和稀盐酸制取二氧化碳。现取25g含碳酸钙的大理石于烧杯中,缓慢加入稀盐酸(大理石中的杂质不溶于水,也不与稀盐酸反应),剩余固体质量与加入稀盐酸的质量关系如图。求:
(1)25g大理石中碳酸钙的质量。
(2)恰好完全反应时所得溶液中溶质的质量分数。

向盛有一定质量铁粉的烧杯中逐滴加入稀硫酸充分反应,产生气体质量与所加稀硫酸质量的关系如图所示。请根据该图信息计算:
(1)铁粉反应完时,产生氢气的质量为 g。
(2)原稀硫酸中溶质的质量分数(写出计算过程)。

超市出现了一种名为“污渍爆炸盐”的洗涤新产品,能在瞬间去除洗衣粉难以除去的多种顽固污渍。某校化学兴趣小组的同学在老师的指导下对该产品开展了以下探究活动。
[阅读标签]本产品不含 ,环保。
[查阅资料]①“污渍爆炸盐”的主要成分是过碳酸钠(Na2CO4),它是一种白色结晶
颗粒,易溶于水,且能与水反应,生成碳酸盐和其他化合物。
②氢氧化镁是不溶于水的白色固体。
[提出问题]“污渍爆炸盐”水溶液的成分是什么呢?
[作出猜想]猜想一:Na2CO3和H2O2猜想二:Na2CO3和NaOH
猜想三:Na2CO3、H2O2和NaOH。
[实验探究]
|
序号 |
实验步骤 |
实验现象 |
实验结论 |
|
① |
取少量“污渍爆炸盐”于烧杯中,加入足量蒸馏水充分搅拌。 |
固体完全溶解形成无色溶液 |
/ |
|
② |
取适量①的溶液于试管中,先向其中加入少量二氧化锰粉末,再将带火星的木条置于试管口 |
有大量气泡产生,木条复燃 |
含有 |
|
③ |
取适量①的溶液于试管中,向其中加入足量 ,振荡、静置。 |
有白色淀产生 |
含有碳酸钠 |
|
④ |
取适量③的上层清液于试中,向其中滴加少量氯化镁溶液,振荡 |
清液中 |
不含氢氧化钠 |
[得出结论]猜想 正确。
请写出过碳酸钠与水反应的化学方程式: 。

文文想通过实验测定稀盐酸的溶质质量分数,他分四次向182.5g稀盐酸中加入含有杂质的锌粉(杂质不溶于盐酸也不与盐酸发生反应),记录所加锌粉质量与产生氢气的质量如下表所示:
|
次数 |
1 |
2 |
3 |
4 |
|
锌粉质量/g |
5 |
5 |
5 |
5 |
|
氢气质量/g |
0.15 |
0.15 |
0.1 |
0 |
请帮文文计算稀盐酸的溶质质量分数。