做酸碱实验时,小敏将稀盐酸逐滴加到氢氧化钡溶液中(如图),发现一直无明显现象,突然想起忘记加无色酚酞试液。为探究反应的进程,过程如下:(已知BaCl2溶液呈中性)
【建立猜想】①氢氧化钡过量 ②盐酸过量
【实验设计】
步骤一:取少量反应后的溶液于试管中,滴入几滴无色酚酞试液,溶液不变色,得出猜想①错误。
步骤二:继续探究
实验方案 |
实验操作 |
实验现象 |
实验结论 |
Ⅰ |
重新取样,滴加少量AgNO3溶液 |
白色沉淀 |
猜想②正确 |
Ⅱ |
重新取样,滴加足量Na2CO3溶液 |
|
猜想②正确 |
白色沉淀 |
猜想③正确 |
(1)对方案Ⅰ的结论进行评价: 。
(2)表格空白处的实验现象是: 。
【表达交流】为确定猜想②是否正确,还可以选择的试剂有 。
A.紫色石蕊试液 B.铜片 C.铁锈

二氧化碳、氢氧化钠、氢氧化钙、氯化钠等都是重要的化工原料,在生产和生活中,有这重要的应用。
(1)二氧化碳用于制汽水,这是利用了二氧化碳 的性质。
(2)用石灰浆粉刷墙壁,干燥后又白又硬。这是因为(用化学方程式表示) 。
(3)厕所清洁剂和炉具清洁剂的作用是不同的。其中,炉具清洁剂中含有 ,利用其能与油脂反应的性质达到去除油污的目的。而厕所清洁剂因含有某些物质,呈强 (“酸”或“碱”)性,能达到消毒杀菌的效果。
(4)工业上,常用电解氯化钠溶液的方法制取氢氧化钠,同时还能获得氢气、氯气两种化工产品,其反应的化学方程式为 。
化学与生活、生产息息相关,请运用化学知识回答以下问题.
(1)湿衣服在阳光下比在阴凉处干得快,这是因为 .
(2)车用乙醇汽油中,乙醇的作用是(用化学方程式表示) .
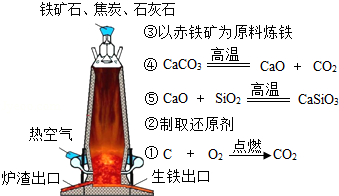
(3)如图是工业上高炉炼铁的模拟图,图中反应③的化学方程式是 .
(4)医疗上“钡餐”的主要成分是硫酸钡,不能用碳酸钡代替硫酸钡的原因是(用化学方程式表示) .
化学是以实验为基础的学科,根据实验一、实验二回答下列问题:
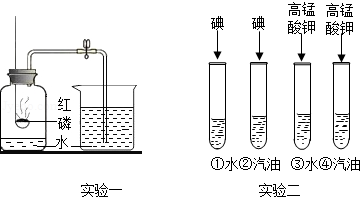
(1)实验一:待红磷熄灭冷却后,打开弹簧夹,观察到集气瓶内水面上升约 ,该现象说明氮气具有的性质是 .
(2)实验二:试管③的现象为 ;将试管②和④的现象相比较得到的结论是 .
通过初中化学的学习,同学们掌握了一些基本的化学知识,初步形成了一些化学观念,具备了一定的化学科学素养.
(1)请完成下列表格:
|
化学符号 |
|
5CH4 |
|
2Cl﹣ |
|
表示意义 |
2个铝原子 |
|
氧化铁 |
|
(2)用所学知识,按要求完成下列各题:
a.周末,小星妈妈做晚饭炒菜时突然来一电话,在接电话时,听到正在忙于中考复习的小星大喊:“妈妈,锅里糊了!”接完电话,妈妈问道:“你又没看到,是怎么知道的?”小星解释道: .
b.“镁条在氧气中燃烧后固体质量增重,则质量守恒定律不适用于该化学反应”.你对这句话如何理解: .
c.前不久,某化妆品的广告片中有一女星高喊:“我们恨化学”,此广告语引起我国化学界高度关注,要求立即停播并公开道歉.你如何评价该广告语: .
A﹣H是初中化学常见物质,如图为这些物质的相互转化关系图,其中E为红色固体,H为红褐色沉淀,其中部分生成物与反应条件已省略.回答下列问题:

(1)F的化学式为 .
(2)E→C化学方程式为 .
(3)上述反应中未涉及的基本反应类型为 .
(4)萃出E→G在工业生产中对应的一种用途 .