酸、碱、盐在生产生活中具有广泛的用途,某固体粉末可能含有CaCO3、Na2SO4、NaCl、BaCl2、CuSO4中的一种或几种。为确定其组成,进行如下实验:
步骤 |
实验操作 |
现象或结论 |
步骤1 |
取少量固体粉末加入足量的蒸馏水溶解并过滤 |
得到白色沉淀A和无色滤液B |
步骤2 |
向A中加入足量的稀盐酸 |
沉淀全部溶解并有气体放出 |
步骤3 |
向B中加入足量的Ba(NO3)2溶液 |
产生白色沉淀C |
下列说法错误的是( )
A.白色沉淀A为CaCO3
B.白色沉淀C为BaSO4
C.原固体粉末中肯定含有Na2SO4
D.原固体粉末中肯定不含NaCl
“民以食为天”,我们青少年正是长身体的关键时期,要注意营养的均衡补充.下列有关健康叙述正确的是()
①正常人每天去都应摄入一定量的蛋白质②油脂会使人发胖,故禁食油脂③维生素由200多种,多数在人体内不能合成,需要从食物中摄取,饮食中要注意补充蔬菜水果等含维生素较多的食品④青少年正处于生长发育阶段,需要多摄入钙,成年人体格已经健全,可以不补充钙.
| A.②③ | B.①② | C.①③ | D.③④ |
厨房是家庭中重要的组成部分.以下在厨房发生的变化中,不属于化学变化的是()



| A.苹果腐烂 | B.榨取果汁 | C.面包发霉 | D.菜刀生锈 |
常温下,在两只各盛有100mL水的烧杯中,分别加入相同质量的甲、乙两种物质,使其充分溶解,结果如图所示.下列说法正确的是()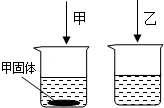
| A.甲溶液是不饱和溶液 |
| B.常温下,甲、乙两种物质的溶解度相同 |
| C.升高温度,剩余的甲固体一定能继续溶解 |
| D.乙溶液可能是饱和溶液,也可能是不饱和溶液 |
除去下列各物质中的少量杂质,所用方法都正确的个数有()
| 序号 |
物质 |
杂质 |
除去杂质的方法 |
| ① |
CuSO4溶液 |
稀H2SO4 |
加入足量氧化铜粉末充分反应后过滤 |
| ② |
NaCl |
MgCl2 |
加入饱和NaCl溶液溶解、过滤、干燥 |
| ③ |
Cu粉 |
Fe粉 |
用磁铁吸出 |
| ④ |
Na2CO3粉末 |
NaHCO3粉末 |
加热 |
A.1个 B.2个 C.3个 D.4个
中国科学技术大学化学家在440℃和高压下,利用金属钠与二氧化碳作用得到了金刚石(化学式:C)和碳酸钠,且金刚石的颗粒有望达到宝石级大小,它将给天然金刚石开采业带来极大挑战.下列说法不正确的是()
A.金刚石是一种单质 B.该反应中生成了新的原子
C.碳是非金属元素 D.该反应是置换反应