无水氯化钙(CaCl 2)是重要的干燥剂,CaCl 2•6H 2O与冰的混合物是实验室常用的制冷剂,将CaCl 2•6H 2O加热可得CaCl 2.某工厂以石灰石为原料生产无水氯化钙的流程如图所示,原料石灰石中含有的杂质主要是MgCO 3、MgSO 4。

(1)过滤和蒸发均用到的玻璃仪器是 。
(2)石灰石溶解时,杂质MgCO 3发生反应的化学方程式为 ,该反应是 (填基本反应类型)
(3)加入BaCl 2溶液除去的杂质离子是 ,加入氢氧化钙溶液除杂的化学方程式为 。
(4)由CaCl 2•6H 2O得到CaCl 2是 变化(填"物理"或"化学")。
配制50g10%的氢氧化钠溶液时,有以下操作:①溶解②称量和量取③计算,其中正确的操作顺序是(填序号);
在配制过程导致溶液中氯化钠质量分数小于10%的可能原因是(填序号)
①用量筒量取水时仰视读数
②量取液体时量筒预先用少量蒸馏水润洗
③盛装溶液的试剂瓶用蒸馏水润洗
④氯化钠晶体不纯
小明在查阅资料时看到这样一段话:“二氧化硫能使紫红色KMnO4溶液变成无色溶液,反应方程式为:5SO2 +2KMnO4+2H2O ==K2SO4 + 2MnSO4 + 2  ” 。方程式中最后一种物质的化学式印刷不清楚,小明根据上下文了解到该物质是一种常见的酸,请根据已学知识推测其化学式:,KMnO4中Mn元素化合价为,
” 。方程式中最后一种物质的化学式印刷不清楚,小明根据上下文了解到该物质是一种常见的酸,请根据已学知识推测其化学式:,KMnO4中Mn元素化合价为,
5SO2中“5”的含义是。
从H、C、O、Na、Ca五种元素中,选择适当的元素填写符合下列要求的物质的化学式:
(1)常用做干燥剂的氧化物;(2)可用做酒精灯燃料的是;
(3)常用来改良酸性土壤的碱;(4)说“碱”不是碱,但其水溶液呈碱性的一种盐;(5)一种有毒的气体;
实验室用如下装置制备几瓶氧气用于性质实验。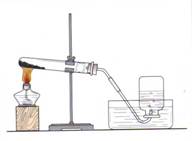
(1)试管中装入的药品是KClO3和MnO2,生成氧气的化学方程式为。
(2)收集氧气的操作过程是:等集气瓶中的水排完后,一只手扶稳集气瓶,另一只手首先小心地将导管从瓶口移开,然后__________,最后把集气瓶 放(填“倒”或“正”)在桌子上。
(3)实验室也常用上述实验装置制备甲烷,推测其反应物是_________(填序号)。
A.CH3COONa固体和碱石灰 B.Al4C3固体和水 C.CO和H2
填写实验仪器名称:
(1)从试剂瓶中取少量溶液到试管中,除了直接倾倒,还经常使用_________取液。(2)实验室过滤粗盐水溶液时,所需玻璃仪器除烧杯、玻璃棒外,还需要_________。