兴趣小组同学在做镁与盐反应的实验时,不小心将镁条加到饱和的碳酸氢钠溶液中,意外发现溶液中有白色不溶物生成。同学们对白色不溶物的成分产生了浓厚兴趣,于是在老师的帮助下进行了如下的探究。

【提出问题】白色不溶物是什么物质?
【猜想与假设】
猜想①是Mg(OH)2
猜想②是MgCO3
猜想③是Mg(OH)2和MgCO3的混合物
【查阅资料】
1.MgCO3、Mg(OH)2加热易分解,分别生成两种氧化物。
2.白色无水硫酸铜遇水变蓝。
3.碱石灰是固体氢氧化钠和氧化钙的混合物。
【实验验证】取适量干燥的白色不溶物,充分加热,并使分解产生的气体依次通过如图1所示装置。
【实验现象】装置A中 ,装置B中 。
【实验结论】猜想③正确。请写出Mg(OH)2受热分解的化学方程式 。
【拓展探究】直接向白色不溶物中滴加足量 ,也能检验MgCO3的存在。
同学们为了进一步测定白色不溶物中各组分的质量关系,继续进行了下列探究。
称取干燥的白色不溶物36.8g,充分加热至不再产生气体,并使分解产生的气体全部被如图2所示装置C和D吸收。
【实验数据】实验后装置C增重3.6g,装置D增重13.2g。
【实验结论】若上述白色不溶物的组成用xMg(OH)2•yMgCO3表示,则x:y= 。
【反思评价】实验后,同学们经过讨论交流,发现实验方案可进一步优化,下列优化方案错误的是 (填序号)。
①只称量装置C、D增重的质量,不称量白色不溶物的质量
②去掉装置D,只称量白色不溶物和装置C增重的质量
③去掉装置C,只称量白色不溶物和装置D增重的质量
老师在讲解溶洞的形成时,告诉了同学们一个新的化学反应:
CaCO3+CO2+H2O=Ca(HCO3)2
化学兴趣小组的同学们提出一个大胆的猜想:“Na2CO3溶液也能与CO2发生反应”.
为了确定同学们的猜想是否正确,兴趣小组在老师的指导下,通过实验探究的方法,完成了对该猜想的判断.请你完成兴趣小组在实验探究活动中的部分实验报告.
【实验目的】:探究Na2CO3溶液能否与CO2反应
【实验药品】:大理石、CaO、Na2CO3溶液、饱和的NaHCO3溶液、CaCl2溶液、浓盐酸、稀硫酸、浓硫酸、澄清石灰水
【查阅资料】:
①2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O;
②Na2CO3+CaCl2═CaCO3↓+2NaCl
③2NaHCO3+CaCl2═CaCO3↓+2NaCl+H2O+CO2↑
④二氧化碳能溶于水,但几乎不溶于饱和NaHCO3溶液
【实验装置】:如图
【实验操作步骤与现象】:
①制取二氧化碳时应选用上述的 (请从以上给出的药品中选择并填药品的名称)
②装置Ⅱ中盛放的饱和NaHCO3溶液的作用是 .
③使过量的CO2通过装置Ш,充分反应后,将其中所得的溶液取出3mL于试管中,然后向试管中加入 试剂(请从以上给出的药品中选择并填药品的名称)
a.当试管中 现象时,Na2CO3溶液与CO2没有发生反应;
b.当试管中 现象时,Na2CO3溶液与CO2发生了化学反应,其反应的化学方程式为 .
【结论】:通过实验探究,同学们的猜想是正确的.
葡萄糖是生命体所需能量的主要来源.
提出问题:葡萄糖燃烧的产物是CO2和H2O,由此能否推断葡萄糖是由碳元素和氢元素组成的有机物?
实验设计:为了确定葡萄糖的元素组成,某小组设计了如下实验(其中浓硫酸、无水CaCl2均为常用干燥剂,部分固定装置省略,假设每个装置中均吸收完全或反应完全。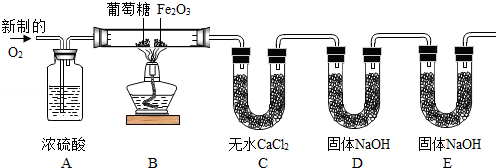
| 小贴士 含碳元素的化合物完全燃烧生成CO2 、H2O,不完全燃烧时生成CO、CO2 和H2O |
(1)装置A中浓硫酸的作用是
(2)装置B处Fe2O3可能发生的化学反应的方程式为 .
方案评价:
用充有空气的储气球代替制备氧气的装置,是否更有利于实验的进行,为什么? .(填“是”或“否”及理由)
数据处理:下表是同学们填写的实验报告,请你帮助完成.
| 实验事实 |
数据分析及结论 |
| 1.8g葡萄糖完全燃烧,得到2.64g CO2和1.08g H2O |
结论:葡萄糖含有 元素 数据分析的依据是 . |
讨论交流:上述实验装置D、E中盛放的都是NaOH固体,试分析两次使用NaOH固体的作用分别是什么? .
CaO和NaOH固体的混合物,俗名“碱石灰”,实验室常用作干燥剂.碱石灰在空气久置会吸收空气中的水和二氧化碳而变质.某实验小组为确定一瓶久置的碱石灰样品的成分,设计了如图所示实验流程. 请你参与探究过程: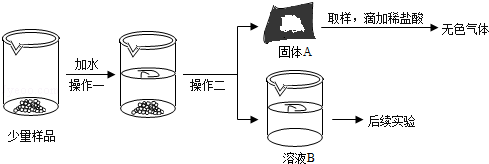
(1)为了使样品充分溶解,操作一定还要用到的玻璃仪器是 ;操作二的名称是 .
(2)固体A中一定含有 .
(3)溶液B成分的探究.
[查阅资料]
①Ca(OH)2、Na2CO3溶于水无明显的温度变化;
②Na2CO3溶液呈碱性,能使酚酞试液变红;
③CaCl2溶液呈中性.
[猜想]
溶液B中溶质可能为:①NaOH; ②Na2CO3; ③NaOH和Na2CO3;④Ca(OH)2和
[设计方案并进行实验]
甲、乙同学分别设计如下方案并进行探究:
甲同学:取少量溶液B于试管中,滴加足量的稀盐酸,产生大量气泡,则溶液B中的溶质是Na2CO3.
乙同学:取少量溶液B于试管中,滴加几滴酚酞试液,溶液变成红色,则溶液B中的溶质一定含有NaOH.
[反思与评价]
丙同学认真分析上述二位同学的实验,认为他们的结论均有不足之处,并且做出了正确的判断.他认为B溶液中一定含有Na2CO3,可能含有NaOH.为进一步确认溶液B中是否含NaOH,做做了如下实验.
| 实验步骤 |
实验现象 |
实验结论 |
| ①取少量溶液B于试管中,加入足量CaCl2溶液; ②过滤,在滤液中滴加酚酞试液 |
①有白色沉淀生成 ②溶液由无色变为红色 |
猜想③正确 |
实验步骤①中发生的化学反应方程式是 ,其实验目的是 .
(4)实验过程中,同学们发现向样品中加水时还放出大量的热.综合以上探究,下列对样品成分分析正确的是 (填序号).
A.一定有NaOH B.一定有Na2CO3 C.一定有CaO D.至少有NaOH、CaO中的一种.
某化学小组在课外活动时做了一个实验,在甲试管中装入固体物质,乙试管中装入液体试剂,按如图所示组装好仪器(图中铁架台等仪器已略去).
(1)若甲试管装入碳酸钠,乙试管装入紫色石蕊试液,丙中加入稀硫酸,打开分液漏斗加入足量的液体,同时打开止水夹.乙试管中的现象为 .立即关闭止水夹,看到 (填甲乙)中液面上升.产生以上现象的原因 (用化学方程式表示)
(2)若乙中装入饱和的石灰水,丙中液体加入到甲中后,石灰水变浑浊.则甲、丙中的物质可能为 (填与(1)中不同的物质).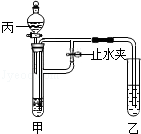
实验室里,试剂瓶的标签常因脱落或被腐蚀而丢失,现有失去标签的6瓶溶液,可能是NaCl、Na2CO3、NaOH、CaCl2、Ca(OH)2、HCl、CuSO4七种物质中的六种,教师将它们编号为A、B、C、D、E、F,让同学们鉴别这六种物质,请你参与小明的下列鉴别过程.
[查阅资料]:CaCl2溶液显中性,CaCl2+Na2CO3=CaCO3↓+2NaCl
(1)观察各种溶液的颜色,其中C瓶为 色,是硫酸铜溶液.
(2)做两两混合实验,E与其他四种物质混合的实验现象记录如下:
| A |
B |
D |
F |
|
| E |
无现象 |
白色沉淀 |
无色气泡 |
白色沉淀 |
由此实验确定 E是 (写化学式),还能确定 .
(3)若只用酚酞溶液,进一步确定另外三种物质的成分,你的实验设计是(填下表):
| 实验操作 |
实验现象及实验结论 |
| |
|
(4)六种物质都鉴别出来以后,小明将NaOH溶液和Na2CO3溶液混合,再滴加稀盐酸,从开始滴加稀盐酸到过量的现象是 ;此时溶液中的溶质为 .