氧气支持生命活动,也是一种重要的化工原料。
(1)实验室用如图所示的装置制取少量氧气。

①仪器a、仪器b的名称分别是 、 。
②锥形瓶内发生反应的化学方程式是 。
(2)工业上有多种制取氧气的方法,如:
方法一:在低温、加压条件下,将空气液化。然后将温度升高至﹣196℃~﹣183℃之间,使液态氮气先蒸发,剩余液态氧气储存于钢瓶里。
方法二:利用电解水的方法制取氧气,将得到的氧气干燥。在低温,加压条件下,使之转化为液态,储存于钢瓶里。
①从构成物质的微粒视角分析,在方法一空气液化过程中,主要改变的是 。
②某工厂用方法二制取氧气,发现氧气的产量略小于理论值,且所得氧气中有淡淡的鱼腥气味。从元素守恒角度分析,该鱼腥气味的气体是 (填化学式或名称)。
(3)氢气和氧气在Pd基催化剂表面可反应生成H2O2,其微观示意图如图:

“解离”时,结构被破坏的分子是 (填化学式)。
(4)为探究双氧水的分解,进行以下两个实验:
①氯化物对双氧水分解的影响。
反应条件:6.0mL 30%双氧水,0.1g氯化物,室温;实验时间:1.5h。
实验数据如表所示:
氯化物 |
NaCl |
MgCl2 |
CuCl2 |
放出氧气的体积/mL |
2.0 |
4.0 |
420.0 |
双氧水的分解率/% |
0.30 |
0.60 |
63.18 |
由上表可知,双氧水保存时应绝对避免引入的离子是 (写离子符号)。
②pH对双氧水分解的影响。
反应条件:6.0mL 30%双氧水,60℃;
用NaOH溶液调pH;实验时间:1.5h。
实验结果如图所示:

由图可知,pH为 (填数字)时,双氧水的分解率最高。
(5)用双氧水可制得“鱼浮灵”“钙多宝”。
①“鱼浮灵”主要成分是2Na2CO3•3H2O2,可迅速增加水体含氧量,其原因是 。
②“钙多宝”主要成分是CaO2,常温下能与水反应生成氢氧化钙和氧气。长时间存放的过氧化钙中含有主要杂质是 (填化学式)、Ca(OH)2。
化学课后,化学兴趣小组的同学在整理实验桌时,发现有一瓶氢氧化钠溶液没有塞橡皮塞,征得老师同意后,开展了 以下探究:
以下探究:
[提出问题1] 该氢氧化钠溶液是否变质了呢?
[实验探究1]
| 实验操作 |
实验现象 |
实验结论 |
| 取少量该溶液于试管中,向溶液中滴加稀盐酸,并不断振荡。 |
有气泡冒出。 |
氢氧化钠溶液一定变质了。 |
[提出问题2] 该氢氧化钠溶液是全部变质还是部分变质呢?
[猜想与假设]
猜想1:氢氧化钠溶液部分变质。
猜想2:氢氧化钠溶液全部变质。
[查阅资料] (1) 氯化钙溶液呈中性。
(2) 氯化钙溶液能与碳酸钠溶液反应:
[实验探究2]
| 实验步骤 |
实验现象 |
实验结论 |
(1)取少量该溶液于试管中,向 溶液中滴加过量 溶液中滴加过量 的氯化钙溶液,并不断振荡。 的氯化钙溶液,并不断振荡。 |
有生成。 |
说明原溶液中一定有碳酸钠。 |
| (2)取步骤(1)试管中的少量上层清液,滴加酚酞溶液。 |
溶液变红色。 |
说明原溶液中一定有。 |
[实验结论] 该氢氧化钠溶液(填"部分"或"全部")变质。
[反思与评价] (1)氢氧化钠溶液露置于空气中容易变质,请写出相关反应的化学方程式:
。
(2)在上述[实验探究2]中,小明提出可用氢氧化钙溶液代替氯化钙溶液,
你认为该方案(填"可行"或"不可行")。
[理解与应用]氢氧化钠溶液容易变质,必须密封保存。实验室必须密封保存的药品还有很
多,试另举一例:。
在学习碳酸钠的性质的课堂上,老师在碳酸钠溶液中加入一定量的澄清石灰水产生白色沉淀,在滤出沉淀后的滤液,引导同学们对滤液中溶质的成分进行探究。同学们通过讨论认为溶质是
、
、
中的一种或两种,其可能情况有三种:①
;②
和
;③。
小伟同学设计了下列实验方案,请你帮助完成。
| 实验步骤 |
可能出现的实验现象 |
实验结论 |
| ⑴取少量滤液于试管中,加入碳酸钠溶液 |
产生 |
假设③成立 |
| ⑵取少量滤液于试管中,加入足量稀盐酸 |
放出无色气体 |
假设成立 |
| ⑶取少量滤液于试管中,加入碳酸钠溶液或足量稀盐酸 |
没有明显现象 |
假设成立 |
小强根据小伟设计的实验方案,在滤液中加入足量稀盐酸,观察到有大量气泡产生,产生该现象化学方程式为。因此他得出的结论是只有假设成立,该假设成立说明教师做的实验是(选填"恰好完全反应"、" 过量"或" 过量")
一次趣味化学活动中,王老师向同学们展示了一瓶标签受损的无色溶液,如下图所示。要求同学们进行探究:确认这瓶溶液导电是什么溶液?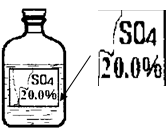
【提出猜想】 王老师提示:这瓶无色溶液只能是下了四种溶液中的一种:①硫酸镁溶液
②硫酸钠溶液、③硫酸溶液、④硫酸铵溶液
【查阅资料】 (1)常温下,相关物质的溶解度如下:
| 物质 |
|
|
|
|
| 溶解度 |
35.1g |
19.5g |
75.4g |
与水任意比互溶 |
(2)
的水溶液显酸性
【实验探究】(1)通过查阅资料,小明同学认为猜想(填序号)不成立,原因是。
(2)为确定其它几种猜想是否正确,小明同学继续进行探究:
| 实验操作 |
实验现象 |
实验结论 |
| ①取该溶液少许于试管中,向其中滴加几滴 溶液 |
溶液中有白色沉淀生成 |
猜想①成立 |
| ②用玻璃棒蘸取少许原溶液滴在pH试纸水,并跟比色卡对照 |
溶液pH小于7 |
猜想③成立 |
小雅同学认为小明实验操作②的结论不正确,她的理由是;
(3)请你设计实验方案,确认该溶液是硫酸铵溶液并完成实验报告:
| 实验操作 |
实验现象 |
实验结论 |
| 取该溶液少许于试管中, |
猜想④成立,该反应的化学方程式为 |
化学课外活动中,小红将稀盐酸加入盛有澄清石灰水的试管中,无明显现象;小强将稀盐酸加入盛有
溶液的试管中,有气体生成。反应结束后,两同学把废液倒入同一废液缸中,观察到废液缸中产生少量的气泡,最终有白色沉淀生成。请回答以下问题:
(1)废液缸中最终生成的白色沉淀是。
(2)通过分析废液缸中的现象,你认为小红实验后的废液中一定含有的物质是。
(3)小强从废液缸中取出废液,过滤,对滤液进行实验探究。他认为滤液中除含有
外,还可能含有
,请你邦他完成下面的实验报告:
| 实验操作 |
实验现象 |
实验结论 |
| 取少量滤液于试管中,加入_ | 滤液中含有
. |
碳酸氢钠是一种重要的盐类物质,在生活中用途广泛。小红同学设计实验对碳酸氢钠的性质进行了探究。请你 参与她的探究活动。
参与她的探究活动。
【探究实验1】碳酸氢钠溶液的酸碱性。
【实验方案】取少量该固体加入试管中,加适量水溶解,再滴入几滴酚酞试液,振荡。现象:溶液变成浅红色。 结论: ①。
【探究实验2】能与酸反应。
【实验方案】取少量该固体加入试管中,滴加稀盐酸。现象: ②。反应的化学方程式为: ③。
【探究实验3】碳酸氢钠的热稳定性 。
。
【实验方案】设计实验装置如图,并进行实验。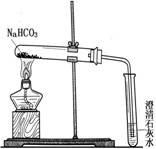
现象: 试管口有水珠出现,澄清石灰水变浑浊。充分加热后,试管中留下白色固体。
结论:碳酸氢钠受热有二氧化碳.水和白色固体生成。
请你帮小红设计实验,证明试管中留下的白色固体是
,而不是
。(所选试剂不能用酸)
步骤: ④;
现象: ⑤。
试写出碳酸氢钠受热发生反应的化学方程式:⑥。
【拓展应用】根据以上探究,请说出碳酸氢钠在日常生活中的一种用途: ⑦。