在我市贡井区、大安区交界处有个地名叫“石灰窑”,生产生石灰有悠久的历史。某校化学实验室一瓶装满生石灰的塑料试剂瓶已经膨胀破裂(如图),该校化学兴趣小组的同学在化学老师的指导下,对该生石灰取样开展了以下探究活动:

【提出问题】
生石灰样品的成分是什么?
【猜想假设】
生石灰样品的成分可能是CaO、Ca(OH)2和CaCO3中的一种或几种。
【设计实验】
兴趣小组设计出如下实验进行探究。
实验操作 |
实验现象 |
实验结论 |
|
(1) |
取样品于烧杯中,加水溶解,用手触摸烧杯外壁。 |
烧杯壁发热。 |
。 |
(2) |
将(1)中液体过滤,取少量滤液于试管中,向其中滴入 。 |
溶液变红。 |
有Ca(OH)2 |
(3) |
取(2)中的少许滤渣于试管中,向其中滴加足量稀盐酸。 |
。 |
有CaCO3 |
【反思评价】
(4)经过讨论,发现通过(2)不能得出样品中一定含有Ca(OH)2,理由是 。
(5)通过小组合作,最后得出样品中肯定含有CaO和CaCO3,可能含有Ca(OH)2。请写出生成CaCO3的化学方程式 。
【应用交流】
(6)生石灰要 保存。
【拓展延伸】
(7)兴趣小组在实验室制取二氧化碳气体的发生装置中连接上压强传感器如图一,测得实验过程中试管内气体压强变化情况如图二。下列说法正确的是 (填大写字母)。
A.ab段试管中液面逐渐上升
B.bc段石灰石与稀盐酸脱离接触
C.c点的对应操作是打开弹簧夹

碲(
)被誉为"现代工业、国防与尖端技术的维生素,创造人间奇迹的桥梁"。实验室模拟提取碲的一个实验是:取某含碲溶液于烧瓶中,加入适量
,加热到一定温度,持续通入
,待反应一定时间,过滤得到粗碲。
(1)反应的总化学方程式为:
则X为(填化学式)。
(2)为探究获得较高粗碲沉淀率的反应条件,某研究小组在控制
浓度和
流量不变的条件下,进行下述对比试验,数据如下:
| 实验 |
温度/℃ |
反应时间/h |
粗碲沉淀率/% |
| a |
65 |
3.0 |
65.0 |
| b |
80 |
3.0 |
98.9 |
| c |
80 |
2.0 |
98.9 |
| d |
90 |
2.0 |
97.0 |
①该小组研究的反应条件是和。
②实验a和b 的目的是。
③在上述四组实验中,最佳的反应条件是
某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验。
(1)请写出镁条与氧气反应的化学方程式。
(2)小明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵守质量守恒定律。
我("同意"或"不同意")小明的观点,因为。
(3)小红按下图装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体。
【提出问题】黄色固体是什么呢?
【查阅资料】
①氧化镁为白色固体
②镁能与氮气反应生成黄色的氮化镁(
)固体;③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
【做出猜想】黄色固体为
【实验探究】请设计实验,验证猜想
| 实验操作 |
实验现象及结论 |
【反思与交流】空气中
的含量远大于
的含量,而镁条在空气中燃烧生成的氧化镁却远多于氮化镁,为什么?请给出合理的解释。
(4)该兴趣小组又做了镁条与盐溶液反应的实验,发现均能产生
,实验现象如下:
| 实验序号 |
实验1 |
实验2 |
实验3 |
|
| 与镁条反应的溶液 |
|
|||
| 实验现象 |
有大量气泡产生 |
有较多气泡产生 |
有少量气泡产生 |
气泡较少 |
| 加热后,实验现象 |
气泡明显增多, 可闻到氨味 |
气泡增多 |
气泡增多 |
气泡增多 |
上表中,用水进行实验的目的是。
根据上表中的实验现象,请写出三条结论,并分析可能的原因(不分析原因,不得分)
①②③
为比较相同浓度的
溶液和
溶液对
分解的催化效果,某研究小组进行了如下探究: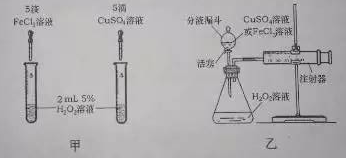
(1)请写出
分解的化学方程式。
【定性探究】
(2)如图甲,可通过观察来定性比较两者的催化效果。
【定量探究】
(3)如图乙,实验前检查该装置气密性的方法是。要定量比较两者的催化效果,可测量生成等体积气体所需的。
【深入探究】
(4)在
溶液中,究竟是哪种离子起催化作用呢?
猜想1:铁离子(
)起催化作用;
猜想2:起催化作用;
猜想3:起催化作用;
……
请设计实验,验证猜想1
| 实验操作 |
实验现象及结论 |
(6分)某化学实验小组用一块表面镀锌的铁样品进行实验探究活动。
【实验探究】将表面镀锌的铁进行如图A实验,加入稀盐酸与产生氢气的质量关系如图B。
【提出问题】反应后所得的无色滤液a的溶质与固体b的成分是什么?
【猜想假设】秦思认为无色滤液a的溶质是(1)、氯化亚铁和氯化氢。
【反思评价】请你评价秦思的猜想(2)。
【推理判断】由无色滤液a 的成分可推知,固体b中一定含有(3)。
【实验与结论】为验证固体b的成分,单杰向b的样品中加入一种有色物质(4)(填化学式)溶液,产生的现象是(5),据此现象,证明出固体b中的两种成分,同时得出这两种金属的活动性顺序。
【表达交流】石建向固体b中继续滴加少量稀盐酸也确定出固体b的成分,他观察到的现象是
(6)。
【拓展延伸】通过比较锌、铁的活动性,结合图像B在开始加入稀盐酸的过程中并没有产生氢气的现象,你认为在铁的表面镀锌的原因是(7),可阻止进一步氧化。
某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究.
【查阅资料】
①生产原料粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质(不与酸反应).
②生产原理反应:NaCl+ NH3 + CO2 + H2O= NaHCO3↓+ NH4Cl,分离得晶体B,并使其充分受热,可分解制得纯碱,同时得到二氧化碳和水.
③氯化铵分解的化学方程式是NH4Cl △ NH3↑+HCl↑.
④部分生产流程如下图所示:
【问题讨论】
(1)①溶液A中的溶质有NaCl和、,
②操作Ⅱ的名称为.
③流程中Na2CO3溶液的作用是除去粗盐中的.
④写出加入NaOH溶液与MgCl2反应的化学方程式.
⑤晶体B受热分解的化学方程式为.
(2)上述生产流程中可循环使用的是(填序号).
A.NaOH B.NH3 C.HCl D.CO2
【组成探究一】
(3)设计实验检验纯碱样品中是否混有晶体B,请完成下表
| 选择的装置 |
实验现象 |
实验结论 |
| 选择的装置(填序号) |
实验现象 |
实验结论 |
| 样品不含晶体B |
【组成探究二】
(4)取纯碱样品加水溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.产生沉淀的方程式为,由此确定纯碱样品含有杂质NaCl.
【组成探究三】
(5)同学们为了测定该纯碱样品的纯度,设计了如下实验: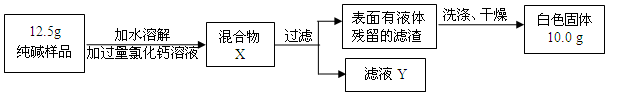
①判断加入氯化钙溶液是否过量的方法是,然后观察现象判断.
②判断滤渣是否洗涤干净,可以采取向最后的洗出液中滴加,然后观察现象判断.
A.氯化钡溶液B.硝酸银溶液 C.碳酸钠溶液 D.稀盐酸
③根据实验数据,计算样品中碳酸钠的质量分数是多少?(写出计算过程.3分)