【选修五:有机化学基础】氧化白藜芦醇W具有抗病毒等作用。下面是利用Heck反应合成W的一种方法:

回答下列问题:
(1)A的化学名称为________。
(2) 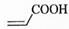 中的官能团名称是________。
中的官能团名称是________。
(3)反应③的类型为________,W的分子式为________。
(4)不同条件对反应④产率的影响见下表:
实验 |
碱 |
溶剂 |
催化剂 |
产率/% |
① |
KOH |
DMF |
|
22.3 |
② |
|
DMF |
|
10.5 |
③ |
|
DMF |
|
12.4 |
④ |
六氢吡啶 |
DMF |
|
31.2 |
⑤ |
六氢吡啶 |
DMA |
|
38.6 |
⑥ |
六氢吡啶 |
NMP |
|
24.5 |
上述实验探究了________和________对反应产率的影响。此外,还可以进一步探究________等对反应产率的影响。
(5)X为D的同分异构体,写出满足如下条件的X的结构简式________。
①含有苯环;②有三种不同化学环境的氢,个数比为6∶2∶1;③ 的X与足量金属Na反应可生成 。
(6)利用Heck反应,由苯和溴乙烷为原料制备  ,写出合成路线________。(无机试剂任选)
,写出合成路线________。(无机试剂任选)
过渡金属元素铬 是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
(1)对于基态 原子,下列叙述正确的是 (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为
B. 电子能量较高,总是在比 电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)三价铬离子能形成多种配位化合物。 中提供电子对形成配位键的原子是 ,中心离子的配位数为 。
(3) 中配体分子 、 以及分子 的空间结构和相应的键角如图所示。

中 的杂化类型是 。 的沸点比 的 ,原因是 。 的键角小于 的,分析原因 。
(4)在金属材料中添加 颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。 具有体心四方结构,如图所示。处于顶角位置的是 原子。设 和 原子半径分别为 和 ,则金属原子空间占有率为 %(列出计算表达式)。

一氯化碘 是一种卤素互化物,具有强氧化性,可与金属直接反应,也可用作有机合成中的碘化剂。回答下列问题:
(1)历史上海藻提碘中得到一种红棕色液体,由于性质相似,Liebig误认为是 ,从而错过了一种新元素的发现。该元素是 。
(2)氯铂酸钡 固体加热时部分分解为 、Pt和 , 时平衡常数 。在一硬质玻璃烧瓶中加入过量 ,抽真空后,通过一支管通入碘蒸气(然后将支管封闭)。在 ,碘蒸气初始压强为 。 平衡时,测得烧瓶中压强为 ,则 ,反应 的平衡常数 (列出计算式即可)。
(3)McMorris 测定和计算了在 范围内下列反应的平衡常数 :
得到 和 均为线性关系,如图所示:

①由图可知, 分解为 和 反应的 (填"大于"或"小于")。
②反应 的 (用 表示);该反应的 (填"大于"或"小于"),写出推理过程 。
(4)Kistiakowsky曾研究了 光化学分解反应,在一定频率(v)光的照射下机理为:
其中 表示一个光子能量, 表示 的激发态。可知,分解 的 需要吸收 的光子。
维生素E是一种人体必需的脂溶性维生素,现已广泛应用于医药、营养品、化妆品等。天然的维生素E由多种生育酚组成,其中α﹣生育酚(化合物E)含量最高,生理活性也最高。下面是化合物E的一种合成路线,其中部分反应略去。

已知以下信息:
a) 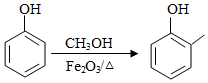
b) 
c) 
回答下列问题:
(1)A的化学名称为 。
(2)B的结构简式为 。
(3)反应物C含有三个甲基,其结构简式为 。
(4)反应⑤的反应类型为 。
(5)反应⑥的化学方程式为 。
(6)化合物C的同分异构体中能同时满足以下三个条件的有 个 (不考虑立体异构体,填标号)。
(ⅰ)含有两个甲基;(ⅱ) 含有酮羰基(但不含C=C=O); (ⅲ) 不含有环状结构。
(a) 4 (b) 6 (c) 8 (d) 10
其中,含有手性碳(注:连有四个不同的原子或基团的碳)的化合物的结构简式为 。
有些离子方程式能表示一类反应,而有些离子方程式却只能表示一个反应。
某同学在进行归纳总结时研究发现:
HCO3-+Ca2++OH-===CaCO3↓+H2O能表示(金属离子仅限Na+与Ca2+)“向NaHCO3溶液中加入过量澄清石灰水”对应的离子方程式;
也可表示: 对应的离子方程式
更可表示: 对应的离子方程式
[生物——选修3:现代生物科学技术]
人类疾病的转基因动物模型常用于致病机理的探讨及治疗药物的筛选。利用正常大鼠制备遗传性高血压转基因模型大鼠的流程如图所示。
(1)卵母细胞除从活体输卵管中采集外,还可从已处死的雌鼠________中获取。
(2)图中的高血压相关基因作为__________,质粒作为_________,二者需用________切割后连接成重组载体,该过程与质粒上含有________有关。
(3)子代大鼠如果________和__________,即可分别在分子水平和个体水平上说明高血压相关基因已成功表达,然后可用其建立高血压转基因动物模型。
(4)在上述转基因大鼠的培育过程中,所用到的主要胚胎工程技术是___________、早期胚胎培养和胚胎移植。