砷(As)是第四周期VA族元素,可以形成 、 、 、 等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图__________。
(2)工业上常将含砷废渣(主要成分为 )制成浆状,通入 氧化,生成 和单质硫。写出发生反应的化学方程式__________。该反应需要在加压下进行,原因是__________。
(3)已知:
则反应 的 __________。
(4)298K时,将 、 和 溶液混合,发生反应: 。溶液中 与反应时间(t)的关系如图所示。
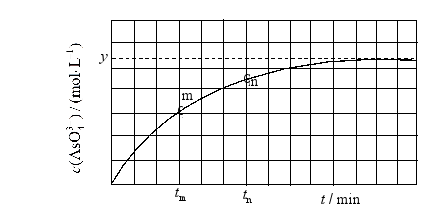
①下列可判断反应达到平衡的是__________(填标号)。
a.溶液的pH不再变化
b.
c. 不再变化
d.
② 时, __________ (填"大于"、"小于"或"等于")。
③ 时 __________ 时 (填"大于"、"小于"或"等于"),理由是__________。
④若平衡时溶液的 ,则该反应的平衡常数K为__________。
[生物——选修3:现代生物科学技术]
人类疾病的转基因动物模型常用于致病机理的探讨及治疗药物的筛选。利用正常大鼠制备遗传性高血压转基因模型大鼠的流程如图所示。
(1)卵母细胞除从活体输卵管中采集外,还可从已处死的雌鼠________中获取。
(2)图中的高血压相关基因作为__________,质粒作为_________,二者需用________切割后连接成重组载体,该过程与质粒上含有________有关。
(3)子代大鼠如果________和__________,即可分别在分子水平和个体水平上说明高血压相关基因已成功表达,然后可用其建立高血压转基因动物模型。
(4)在上述转基因大鼠的培育过程中,所用到的主要胚胎工程技术是___________、早期胚胎培养和胚胎移植。
[生物——选修1:生物技术实践]
许多植物含有天然香料,如薄荷叶中含有薄荷油。现用薄荷叶提取薄荷油。
回答问题:
(1)薄荷油是挥发性物质,提取薄荷油时应选用____(鲜、干)薄荷叶作原料,其原因是_____。
(2)用萃取法提取薄荷油时,采用的溶剂是______,原理是_______。
(3)用水蒸气蒸馏法提取薄荷油时,在油水混合物中加入氯化钠的作用是______。常用于分离油层和水层的器皿是______。分离出的油层中加入无水硫酸钠的作用是______,除去固体硫酸钠的常用方法是_______。
下图甲表示在一定条件下测得的该植物光照强度与光合速率的关系;图乙表示某绿色植物的细胞代谢状况;图丙是某兴趣小组将植物栽培在密闭玻璃温室中,用红外线测量仪测得室内的CO2浓度与时间关系的曲线。请分析回答:
(1)图甲中的a点表示______,c点时,叶肉细胞中产生ATP的场所有。
(2)图乙所示的该植物细胞代谢情况,可用图甲中a、b、c、d四点中的哪一点来表示?
。
(3)在光照强度大于____klx时,植物才会表现出生长现象。在相同温度下,将该植物的叶片置于8 klx光照下9小时,然后移到黑暗处15小时,则该24小时内每100 cm2叶片的光合作用所消耗的CO2的量为mg。
(4)若图甲曲线表示该植物在25℃时光照强度与光合速率的关系,并且已知该植物光合作用和呼吸作用的最适温度分别为25℃和30℃,那么在原有条件不变的情况下 ,将温度提高到30℃,理论上分析c点将____(左移、右移、不变)。
,将温度提高到30℃,理论上分析c点将____(左移、右移、不变)。
(5)由图丙可推知,密闭玻璃温室中氧气浓度最大的是________点,光合速率与呼吸速率相等的点是______,j点与e点相比植物体内有机物含量将_______(增加、减少、不变)。
在小鼠中,有一复等位基因:A控制黄色,纯合子致死;a1控制鼠色,野生型;a2控制非鼠色(黑色)。这一复等位基因系列位于常染色体上,A对a1、a2为显性,a1对a2为显 性。AA个体在胚胎期死亡。请回答:
性。AA个体在胚胎期死亡。请回答:
(1)若Aa2(黄)×a1a1(鼠色)交配,其子代的表现型是。
(2)假定进行很多Aa2×a1a2的杂交,平均每窝生8只小鼠。在同样条件下,进行很多Aa2×Aa2杂交,预期每窝平均生____只小鼠,其表现型及比例为。
(3)一只黄色雄鼠(A_)与几只鼠色雌鼠(a1a2)杂交,在子代中____(能、不能)同时得到鼠色和非鼠色小鼠。原因是 。
。
下图甲是某高等动物细胞亚显微结构示意图,图乙是该动物体内5个不同分裂时期细胞图。请据图回答以下问题。
(1)②上的在细胞互相识别时起重要作用。K+在进入甲细胞时,需要消耗细胞质基质以及[ ](填序号和名称)提供的能量,这表明K+的跨膜运输方式是。
(2)细胞中蛋白质的“装配车间”是[ ](填序号和名称)。甲图中[ ]
](填序号和名称)。甲图中[ ]
(填序号和名称)是膜面积最大的细胞器,为多种酶提供了大量的附着位点,有利于膜上化学反应的进行。
(3)在乙图中:[⑩]染色体上有条脱氧核苷酸链。含有四个染色体组的细胞分裂图像是(填字母),D所示的细胞和体细胞在染色体组成上的最大区别是。乙图中代表减数分裂的细胞在减数分裂中出现的先后顺序
是(填字母)。