一种“贴身暖宝宝”的使用说明书如下,某化学兴趣小组围绕袋内物质展开探究。
品名:XX牌贴身暖宝宝 成分:袋内物质:铁粉、水、活性炭、食盐等 内袋材料:微孔透气无纺布 外袋材料:不透气塑料 用法:临使用前,打开外袋取出内袋,直接贴在衣服上,打开外袋后保持温暖12小时 |
【提出问题】袋内是否含有铁粉?
【进行实验】①取出袋内粉末于滤纸上,与磁铁充分接触。②将少量磁铁吸出的粉末加入足量稀硫酸中。
【收集证据】磁铁吸出的粉末与稀硫酸剧烈反应得到浅绿色溶液、同时_____。
【得出结论】袋内含有铁粉。
【做出猜想】被磁铁吸出的铁粉能在空气中燃烧。
【获取事实】将少许铁粉撒在酒精灯火焰上,铁粉立即剧烈燃烧、火星四射。
【反思交流】铁粉燃烧反应的化学方程式为__________。铁丝不能而铁粉能在空气中燃烧的原因是__________。
【拓展探究】用不同燃料测定空气里氧气的含量:分别在图甲所示装置的燃烧匙内放置铁粉、红磷(均足量),电加热引燃。氧气含量随时间变化情况如图乙、图丙:

(1)温度传感器显示,实验过程中瓶内温度均_____(填“升高”或“降低”)。
(2)待铁粉熄灭并恢复至室温后,打开弹簧夹,进入瓶内的水约占原水面上方空间体积的_____。
(3)分析图乙、图丙可知,实验中消耗氧气更彻底的是_____(填“铁粉”或“红磷”,下同),消耗氧气速率更快的是_____。
从海水中得到的粗盐,往往含有可溶性杂质(主要有Na2SO4、MgCl2、CaCl2)和不溶性杂质(泥沙等),必须进行分离和提纯后才能用于工业生产和人们的日常生活.粗盐提纯的部分流程如下:
其中,滤液一→滤液二之间需进行三步操作:
操作①:加入过量Na2CO3,除去滤液中的Ca2+
操作②:加入过量X,除去滤液中的Mg2+
操作③:加入过量BaCl2,除去滤液中的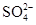
请回答:
(1)操作②中的物质X为________________,正确的操作顺序为________(填序号),为最终获得精盐,操作①、②和③后还需增加的操作是________________;
(2)滤液二中加入适量稀盐酸的目的是________________________.
氯化钠是生活必需品,也是重要的化工原料.提纯含少量泥沙的粗盐,一般经过以下操作流程:
(1)操作①中必须用到的一种仪器是________(填序号).
(A)研钵
(B)量筒
(C)烧杯
(D)试管
(2)操作④中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是________(填序号).
(3)操作⑤中除用到三脚架、酒精灯、玻璃棒、坩埚钳外,还需要用到________等仪器.该操作中容易造成食盐固体飞溅,为尽量减少飞溅,除连续搅拌外还可采取________等措施.
(4)实验结束后称量获得的精盐,并计算精盐的制得率,发现制得率较低,其可能原因是________(填序号).
(A)食盐没有全部溶解即过滤
(B)蒸发时食盐飞溅剧烈
(C)蒸发后,所得精盐很潮湿
(D)器皿上沾有的精盐没全部转移到称量纸上
圆梦中学化学兴趣小组根据所学的酸碱指示剂的知识,准备自制酸碱指示剂:她们分别用蓝紫色牵牛花、大红色、月季花、紫萝卜花、丝瓜花提取指示剂。
步骤1:分别在研钵中将上述物质倒烂,加乙醇溶液(乙醇和水的体积比为1:1)浸泡10分钟。
(1)用研钵捣烂的目的是_________;(2)乙醇在其中起到的作用是_________。
| A.催化剂 | B.参加化学反应 | C.溶质 | D.溶剂 |
步骤2:将步骤1得到的混合物,用纱布过滤;(3)过滤的目的是_________。
步骤3:将步骤2中得到的浸取液,分别滴入到澄清石灰水中。
(4) 上述四种浸取液,最不适合用作酸碱指示剂的_______(填名称) 。
(5) 将月季花的浸取液滴入稀盐酸中,溶液呈_______色;低入氢氧化钠溶液中,溶液呈_______色。
圆梦中学化学学习兴趣小组在研究碱的化学性质实验课堂中发现,盛放NaOH溶液的试剂瓶瓶口和橡皮塞上都出现了白色粉末。为了知道该白色粉末是什么,小王、小李和小刘决定共同探究这种白色粉末的成分。他们依据所学的化学知识,对这种白色粉末的成分作了如下猜想① 可能是NaOH; ② 可能是Na2CO3; ③ 可能是NaOH与Na2CO3的混合物。为了验证猜想,他们分别做了下面的实验。
(1)小王取少量白色粉末溶于水,向所得溶液中滴加酚酞试液,溶液变为红色。由此小军认为白色粉末是NaOH。请判断小军所得结论是否正确,并简述理由。
_______,____________________________________________________________________。
(2)小李取少量白色粉末溶于水,向所得溶液中滴加BaCl2试液,有白色沉淀产生。由此判断白色粉末中含有______。为了验证猜想③,小刘继续向溶液中滴加BaCl2试液至不再产生沉淀,然后过滤。你认为她接下来还应进行的实验是___________ ____________________;在小刘所做的实验中,若把BaCl2溶液换成Ba(OH)2溶液是否可行?请简述理由。_________,_______________________________________________________。
某校兴趣小组对氢氧化钠溶液与稀盐酸混合后的有关问题,进行了如下探究,请同学们一起参与此次探究之旅.
(1)探究一:判断氢氧化钠溶液与稀盐酸混合后是否恰好完全中和?
[方案设计]小亮、小丽、小林三位同学设计了如下方案进行探究:
| 方案设计者 |
方案步骤 |
方案预估现象 |
方案预估结论 |
| 小亮 |
取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞溶液,振荡 |
酚酞溶液不变色 |
恰好完全中和 |
| 小丽 |
用一根洁净的玻璃棒蘸取反应后的溶液沾在pH试纸上,把试纸呈现的颜色与标准比色卡对照 |
pH=7 |
恰好完全中和 |
| 小林 |
取少量反应后的溶液于一支试管中,并向试管中滴加稀硝酸和硝酸银溶液 |
有白色沉淀生成 |
盐酸过量,没有完全中和 |
[方案评价]请判断以上设计的三个方案中,____① ____同学的方案是正确的.
[方案反思]请分析另外两个方案错误的原因:____②____;____③____.
(2)探究二:氢氧化钠溶液与稀盐酸混合后,所得溶液中溶质的成分是什么?
[作出猜想]小亮猜想:溶质有NaCl、HCl、NaOH;
小丽猜想:溶质只有NaCl;
小林猜想:溶质有NaCl、HCl;
你的猜想:溶质有____①____(填化学式).
小丽认为小亮的猜想是错误是,她的理由是____②____.
[实验设计及验证]请你将下列报告填写完整:
| 实验操作 |
实验现象 |
实验结论 |
| 取反应后的溶液于试管中,加入碳 酸钠溶液 |
③ |
小林猜想正确 |
| ④ |
有蓝色沉淀生成 |
你的猜想正确 |