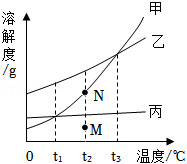
甲、乙、丙三种固体物质的溶解度曲线如图所示。回答下列问题:
(1)在_____ 时,甲、乙的溶解度相等。
(2) 时,将甲溶液的状态由 点变为 点,可采用的方法是_____(回答一种即可)。
(3)将 甲、乙、丙的饱和溶液,分别降温到 ,所得溶液的溶质质量分数最大的是_____。
(4) 时,将等质量的甲、乙、丙的饱和溶液,均恒温蒸发等质量的水,析出溶质质量由多到少的顺序为_____。
上海世博会期间对大量盆栽鲜花施用了S一诱抗素制剂,以保证鲜花盛开。已知
S-诱抗素分子的化学式为C1 5H20O4。请回答:
(1)s-诱抗素中碳、氢、氧三种元素的质量比为
(2)S一诱抗素中氧元素的质量分数为。
(3)世博园的建设大量使用了太阳能、地热能、风能等新能源技术,它们将有利于;面对当今世界能源危机,为了警示人们,请你拟一条公益广告语。
某化学兴趣小组的同学对一瓶久置的熟石灰粉末的组成进行实验探究,请你
一起参与他们的探究活动。
[提出问题]这瓶熟石灰粉末是否已经变质生或了CaCO3?
[进行猜想]猜想一:熟石灰全部变成了CaCO3。
猜想二:熟石灰部分变成了CaCO3。
猜想三:熟石灰没有变质。
[设计实验]该小组同学对猜想一设计了下列探究方案,请你帮助他们完成下表中相关实验内容。
| 实验步骤 |
实验现象 |
实验结论 |
| ①取样,加适量水,搅拌,过滤 ②取少量滤液于试管中,滴入酚酞试液 ③取少量滤渣于试管中,加入盐酸 |
②。 ③。 |
猜想成立 |
[反思与应用]①要证明猜想二成立,可参照上述实验方案进行探究,在步骤②中产生的实验现象是。
②熟石灰变质是由于的缘故。在初中化学我们所学过的物质中还有
(举一例)等具有这样的性质,因此象熟石灰这类物质在实验室应保存。
某天然矿泉水的主要成份如下,请认真阅读后填空。
| 主要成分(mg/L): 碳酸氢根(HCO3-):173—205氯离子(Cl-):1.0—8.0 硫酸根(SO42-):16.08—19.52 |
(1)“SO42-”中数字“2”的含义是。
(2)该矿泉水是。(填“纯净物”或“混合物”)
2010年我国青海玉树县发生了7.1级地震,志愿者到了玉树后出现了“高原反应”,因为当地空气较稀薄,其中O2的体积分数______21%(填>、=或<);在搜救过程中用搜救犬,搜救犬能找到被压灾民的原因是____________________________________________(简要的用分子的观点来解释)
已知A、B、C、D、E分别是稀盐酸、氢氧化钠溶液、硫酸铜溶液 、氧化铁和一氧化碳中的一种,E是实验室一种常见溶液,它们之间的关系如图所示,“─”两端的物质在一定条件下可以反应。请回答: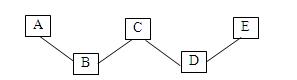
(1)C的一种用途是______;D、E反应的化学方程式为______。
(2)上述各物质间的反应均可用“甲+乙→丙+丁”表示,其中不属于四种基本反应类型,但能用上式表示的一个化学方程式是____。
(3)若B、C、D、E都不变,五种物质之间的关系也不变,A还可能是______。