为使无明显现象的化学反应“可视化”,某兴趣小组的同学开展了下列实验。

I.按图1进行实验,使氢氧化钠与硫酸反应“可视化”。
(1)滴入几滴酚酞溶液,溶液变红,说明氢氧化钠溶液pH 7(填“>”、“=”或“<”)。
(2)将稀硫酸缓慢注入瓶中并振荡,观察到红色褪去,说明氢氧化钠与硫酸发生了反应,此时瓶中溶质(酚酞除外)一定有 。
Ⅱ.按图2进行实验,使氢氧化钠与二氧化碳反应“可视化”。
(3)将注射器中相同体积的 溶液和水同时注入锥形瓶中,观察到 现象,说明氢氧化钠与二氧化碳发生了反应,反应的化学方程式为 。
Ⅲ.进行下列实验,使氢氧化钠与盐酸反应“可视化”。
查阅文献得知:① 溶解于乙醇的速率较慢,20℃时其在乙醇中的溶解度为14g/100mL;②乙醇密度为0.8g/mL;③氯化钠难溶于乙醇。
(4)20℃时,用小烧杯称取2.0g 固体,加入50.0mL乙醇,用玻璃棒不断搅拌约20分钟,静置,烧杯底部有少量固体,此时上层清液为 (填“饱和”或“不饱和”)溶 液。20℃时, 的乙醇饱和溶液中溶质质量分数为 (保留到0.1%)。
(5)取按下表比例配制的乙醇—蒸馏水混合溶剂各20.0mL于三只烧杯中,分别加入 固体搅拌,至有固体未溶解时,停止加入 。
|
烧杯编号 |
乙醇体积:蒸馏水体积 |
溶解 的质量/g |
|
① |
4:1 |
1.1 |
|
② |
3:1 |
1.4 |
|
③ |
1:1 |
3.1 |
分析上表数据,可得出的结论是 。
在上述三只烧杯中均加入10.0mL相同浓度 的乙醇溶液。搅拌并静置后,发现三只烧杯中均有固体,说明氢氧化钠与盐酸发生了反应,且烧杯③中固体最少,主要原因是 。
【总结反思】对于没有明显现象的化学反应,为了证明反应的发生,可以借助指示剂、 、测量温度变化、借助传感器等,提供间接的实验证据。
(2分)家长每天都去菜市场买菜,市场的小商贩不知何时开始又免费提供塑料袋了,于是每个买菜人又恢复了如图所示的这种状态,塑料袋又开始泛滥了……
看到此情景你的感受是(1)___________________________;
为了改善此状况,你的建议是(2)___________________________。
燃料的使用促进了经济的发展,给人们的生活带来了便利。但煤燃烧时,排放的污染物会导致酸雨的发生。这一问题日益受到人们的关注和重视,请你说出酸雨的危害及防治措施。(危害答一点,措施答两点即可)
为绿化环境并改善空气质量,在城市公路两侧种植了树木。园林工人常在树木上涂刷含有硫黄粉等的石灰浆。这样做的目的是什么?(答一点即可)你还知道氢氧化钙的其它用途吗?(答两点即可)
如图所示,某同学探究金属化学性质的实验。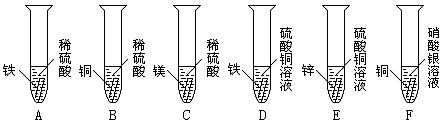
⑴上述实验中,有气泡产生的是(填写装置序号)_____________________。
⑵F中出现的现象是_____________________。
⑶通过上述实验,能否证明镁、锌、铁、铜、银五种金属的活动顺序?并说明理由。
。
⑷我国古代“湿法冶铜”就是利用了D中的反应原理,请写出该反应的化学方程式。
化学实验是科学探究的重要途径。请根据下列实验图示回答相关问题: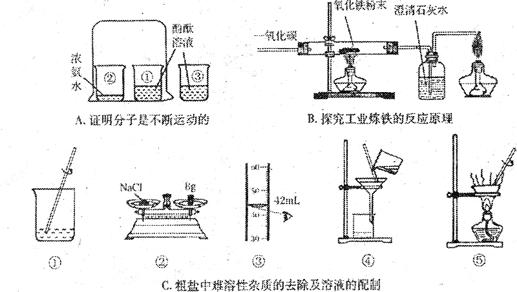
(1)A实验中,烧杯③的作用是。
(2)B实验中,硬质玻璃管中的现象是;装置末端酒精灯的作用是。
(3)C实验中,若要除去粗盐中难溶性的杂质,其正确操作步骤为 (填序号);若按照②③①的步骤配制50 gl6%的氯化钠溶液,所配制溶液的溶质质量分数
(填“偏小”或“偏大”)。