2020年10月,我国基于中科院团队开发的电催化分解水制氢和二氧化碳加氢催化制甲醇( )两项关键创新技术,建成年产“液态阳光”甲醇1440吨的装置。该装置将太阳能转化为可储存运输的化学能,并将二氧化碳作为碳资源转化利用,解决氢能储存和运输的安全难题等问题,对我国能源安全乃至改善全球生态平衡具有重大战略意义。其生产流程示意图如下:

(1)该生产流程中循环利用的物质是 。
(2)二氧化碳与氢气合成甲醇同时生成水,该反应的化学方程式为 。
(3)提供44吨 利用上述流程生产甲醇,不考虑物质损耗,可产生 吨。
(4)该流程制备甲醇除对环境无污染、物质的循环利用外,还有的优点是 (答一点)。
.(6分)胃酸分泌过多的人不宜多饮碳酸型饮料,因为其中溶有较多的CO2气体,该气体能与水反应生成一种酸,该酸的化学式是,其水溶液能使紫色石蕊溶液变红色;向敞口放置一段时间后部分变质的烧碱溶液中滴加稀盐酸,产生的现象是,所发生的反应中,属于中和反应的化学方程式是。
南宁至钦州段的高速铁路正在建设中。请回答下列问题:
(1)铁路建设中大量使用了以下材料:①石子;②钢筋水泥柱;③钢轨等,其中钢轨属于。
| A. | 金属材料 | B. | 合成材料 | C. | 有机天然材料 | D. | 无机非金属材料 |
(2)建设中,常用铝和氧化铁(
)在高温条件下,反应生成熔融状态下的铁单质对钢轨中的缝隙进行焊接。反应的化学方程式为:
,则
的化学式为,该反应的基本类型是。
(3)钢轨长时间使用后会生锈。铁锈的主要成分是
;除铁锈常用的一种试剂是。
(4)请写出防止铁制品锈蚀的两种常用方法:①;②。
(1)钦州盛产食盐,盐场生产的粗盐属于(填"纯净物"或"混合物"),其主要成分的化学名称是,此成分属于(填"单质"或"化合物")。
(2)从① ② ③ ④ ⑤
五种物质中,选择适当的物质用序号填空:
a.空气中含量最多的气体是;b.植物光合作用的主要原料之一是;
c.能燃烧的气体是;d.可填充霓虹灯且通电时会发出有色光的是。
用化学符号表示:
①氢元素;
②一个钠离子;
③三个碳原子;
④氧化镁;
⑤硫酸;
⑥一种常见的氮肥.
已知浓硫酸与焦炭在加热的条件下能发生反应,生成三种氧化物。某校研究性学习小组对此进行以下一系列的探究活动。
【提出猜想】浓硫酸与焦炭在加热条件下反应,生成
和
。
【查阅资料】经查阅资料得知:①
、
均可使澄清石灰水变浑浊;②
可使品红溶液的红色褪去,而
不能;③
可与酸性的
溶液反应使其褪色,而
不能;④无水
为白色粉末,遇水可生成蓝色胆矾。
【实验探究】用以下
四个装置组装成一套完整的实验装置,然后进行实验,验证猜想。
(1)本实验的发生装置应选用如下图所示三种装置中的装置(填序号)。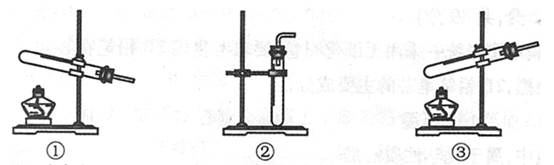
(2)为了验证三种产物,达到预期的实验目的,整套实验装置的正确组装顺序是(按导管口连接的先后顺序):发生装置导管口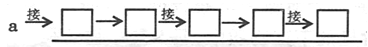
(3)实验过程中,同学们观察到装置
中的无水
变为蓝色,由此得出产物中有的结论;同时还观察到以下实验现象:装置
中品红溶液( I)和酸性高锰酸钾溶液都褪色,品红溶液(Ⅱ)不褪色;装置
中澄清石灰水变浑浊。装置
中品红溶液( I)褪色,说明产物中有,酸性
溶液的作用是,品红溶液(Ⅱ)不褪色,说明;装置
中发生反应的化学方程式是.
(4)能确认反应产物中有
的实验现象是。
【实验结论】本实验提出的猜想(填"成立"或"不成立");
浓硫酸与木炭反应的化学方程式是。
【交流讨论】实验结束后,同学们针对本实验进行讨论,其中张辉同学提出了"反应产物中可能还有一氧化碳"这样的一个观点。你是否支持张辉同学的观点?(填"支持"或"不支持"),请你说出两点理由:①;②。