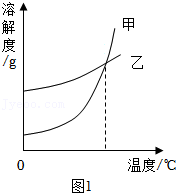
和 在不同温度时的溶解度如下表,两种物质的溶解度曲线如图1:
|
温度℃ |
20 |
30 |
50 |
60 |
80 |
|
|
溶解度/g |
|
110 |
114 |
121 |
126 |
139 |
|
|
31.6 |
45.8 |
85.5 |
110 |
169 |
|
(1)图1中能表示 溶解度曲线的是 (填“甲”或“乙”);
(2)在30℃时,将 和 分别加入到 水中,充分搅拌,可形成饱和溶液的物质为 (填写化学式);
(3)将20℃时 的饱和溶液升温至60℃。若要使溶液重新达到饱和,至少应加入 g ;
(4)在20℃时,将不饱和的 溶液变为饱和溶液的两种常用方法:①恒温蒸发出一部分水,②加入一定质量 固体,上述两种操作均使溶液刚好达到饱和。若将①中的水与②中的 固体混合,所得溶液的质量分数为 (精确到1%)。
联系学过的化学知识,回答下列问题
(1)古代“丝绸之路”运输的商品有丝绸、陶瓷、铁器等,其中陶瓷属于 (填字母序号)
A.金属材料B.无机非金属材料C.复合材料 D.有机高分子材料
(2)活性炭能除去冰箱内的异味,这是利用活性炭的 性;
(3)碳酸氢钠(NaHCO3)可用作干粉灭火剂,灭火时,碳酸氢钠粉末受热生成碳酸钠和两种常见的氧化物,请写出该反应的化学方程式 ,其基本反应类型为 。
下列化学符号中,数字“2”可表示不同的意义,氢回答下列问题(填数字序号)
①2CO ②S2﹣③ O
O
(1)表示分子个数是
(2)表示元素化合价的是 。
(3)表示一个离子所带电荷数值的是 。
化学就在我们身边,人类的衣、食、住、行都离不开化学.
(1)在厨房里蕴藏着许多化学知识.
①下列食物中,能提供大量维生素的是 (填字母).

②加铁酱油中的“铁”是指 (填“元素”或“原子”),身体缺铁会引起贫血,
③厨房中能用来除水垢的物质是 .
④为防止菜刀生锈,可采用的一种措施是 .
(2)汽车、高铁、飞机等已成为人们出行的常用交通工具.
①汽油是汽车常用的一种燃料,将石油加热,利用各成分的沸点不同将它们分离可得到汽油,该过程属于 变化,汽车的铅蓄电池工作时,发生如下化学反应:
Pb+PbO2+2H2SO4=2PbSO4+2H2O
该反应涉及的物质中属于氧化物的有 .
②高铁车头的玻璃是用无机玻璃、树脂、塑料等粘合而成,能耐受强大的撞击力,这种玻璃属于 (填字母).
A.复合材料 B.合成材料 C.金属材料
③制作飞机使用了硬铝(铝铜镁硅合金),其中镁元素的某种粒子结构示意图为 ,镁原子的最外层电子数是 .
,镁原子的最外层电子数是 .
根据下列反应事实写出相应的化学方程式.
(1)双氧水在二氧化锰的催化作用下生成水和氧气: .
(2)在尘埃的作用下,二氧化硫和氧气反应生成三氧化硫(SO 3): .
(3)Cu和AgNO 3溶液反应,生成Cu(NO 3) 2溶液和Ag: .
(4)少量CuSO 4溶液滴入NaOH稀溶液中生成Cu(OH) 2沉淀和Na 2SO 4溶液: .
(5)一氧化碳和四氧化三铁(Fe 3O 4)在高温下反应,生成铁和二氧化碳: .
化学与人类生活、生产息息相关.请回答下列问题:
(1)可燃冰的主要成分是甲烷水合物,燃烧时化学能转化为 能.
(2)用灯帽盖灭酒精灯火焰的原理是 .
(3)用洗洁精除去餐具上的油污是因为洗洁精在水中对油污具有 作用.
(4)家庭用净水器利用活性炭的 性,除去有色有味的杂质.
(5)人体缺钙易患的疾病是 (用序号填写).
①骨质疏松 ②贫血.