在学习人教版九年级化学下册第十单元课题1“常见的酸和碱”时,教师演示了饱和氢氧化钙溶液导电性实验,如图所示。
请根据要求回答下列问题。
实验用品:
直流电源、导线、石墨电极、灯泡、带刻度的烧杯、温度计、开关。
100mL饱和 溶液。
实验现象:
灯泡发光,两电极分别有气泡产生,烧杯内液面下降,与电源正极相连的石墨电极周围出现较多白色浑浊物,溶液温度升高。
分析:液面下降是因为水被电解。电源正极产生的气体为 (用化学式表示)。
【提出问题】溶液出现白色浑浊物的原因是什么?
【查阅资料】氢氧化钙微溶于水
【作出猜想】
猜想Ⅰ:溶液温度升高,氢氧化钙溶解度变小,溶质析出。
猜想Ⅱ: ,溶质析出。
猜想Ⅲ:石墨电极与生成气体发生反应,导致产生白色浑浊物。
【实验探究】溶液出现白色浑浊物的原因
|
实验 |
实验操作 |
实验现象 |
实验结论 |
|
① |
取相同条件下的100mL饱和 溶液于大烧杯中,加热至演示实验溶液上升的温度(温度升高约4℃)。 |
溶液中几乎无白色浑浊物。 |
猜想Ⅰ |
|
② |
将相同条件下的 mL饱和 溶液加热蒸发掉部分水(蒸发掉水的体积与演示实验减少水的体积相同)。 |
溶液中出现少量白色浑浊物。 |
猜想Ⅱ成立但不是溶液变浑浊主要原因。 |
|
③ |
向90mL相同浓度饱和 溶液中加入10mL蒸馏水,搅拌,其余条件不变,重复进行演示实验操作。 |
两电极分别有气泡冒出, 。 |
猜想Ⅲ成立且是溶液变浑浊主要原因。 |
|
④ |
使用铂电极代替石墨电极,重复进行实验③。 |
两电极分别有气泡冒出,溶液中无白色浑浊物。 |
【总结反思】
(1)白色浑浊物的成分为 (用化学式表示)。
(2)用化学方程式表示主要浑浊物的成因 。

【2015贵州省安顺市】竹炭包是一种集观赏与空气净化为一体的产品。这种产品可对车内及室内空气中的一氧化碳、甲醛等有害气体进行吸附。某课外活动小组对竹炭进行初步探究。
【提 出 问题】竹炭中是否含有碳元素
【猜想与假设】竹炭中含有碳元素
【查 阅 资料】新鲜的血液,遇一氧化碳由鲜红变为暗红。
【设 计 实验】所用装置如下图所示。(A装置的作用为吸收空气中的水和二氧化碳)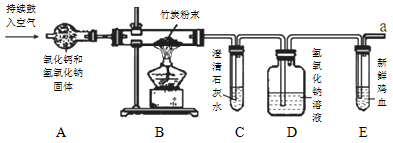
(1)实验开始后,C装置中产生白色沉淀,发生反应的化学方程式为 ,E装置中新鲜的鸡血变为暗红色。
(2)小玥认为应在A、B装置间,再增加一个C装置,目的是 。
(3)课外活动小组的同学设计的这套装置的不足之处是 ,请你设计解决的方法 。
(4)小亮认为可以用右图所示的装置,替换原装置中的E装置,
你认为 (填“可以”或“不可以”),原因是 。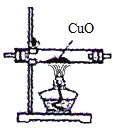
【结论】竹炭中含有碳元素。
【拓展应用】竹炭细密多孔,竹炭牙膏中含有竹炭等成分具有消炎、止痛、化淤、去污等功效,下列有关竹炭牙膏的用途描述不正确的是 。
A、可除衣领袖口等处的汗渍B、不能除去口中异味C、虫咬、灼伤可消炎止痛
【2015年广东省】“题23图”为某家长带小孩在下水道井盖小孔上点燃鞭炮发生爆炸的画面。现要探究某下水道的可燃性气体成分:
【猜想】(I)含可燃性气体CO;(II)含可燃性气体CH4;
(III)含可燃性气体CO和CH4 。
【收集气体】用大的可乐塑料瓶装满水,打开瓶盖用绳子吊入下水道中,用铁钩将矿泉水瓶倒转,使 ,将瓶提到井口迅速盖好瓶备用。
【进行实验】
| 步骤 |
实验搡作 |
实验现象 |
结论 |
| ⑴ |
导出瓶中气体,,通过装有 的洗气瓶。 |
 |
目的是除CO2等 酸性气体。 |
| ⑵ |
再通过装有浓硫酸的洗气瓶。 |
 |
目的是除去 。 |
| 将步骤(2)的气体导出点燃; ①用吸附少量无水硫酸铜粉末的石棉贴在小烧杯内壁,再把小烧杯斜罩于火焰上方; ②用内壁粘有澄清石灰水的小烧杯罩于火焰上方。 |
无水硫酸铜 ; ‚烧杯内壁变浑浊。 |
证明有H2O生成; ‚证明有 生成。 |
【作出判断】根据上述实验现象,甲同学认为猜想III正确;而乙同学认为甲的判断不严谨。
因为猜想 也有相同的现象。如需进一步确认还应检验 的存在,
其方法是 。
【拓展】若需要工人进入下水道清理淤泥,打开下水道井盖后应首先进行的操作是 。
【2015年上海市】甲同学设计了如下实验装置验证一氧化碳的部分性质并验证产物。实验时,在点燃B处酒精灯之前先通入一氧化碳排出装置中的空气,然后继续实验。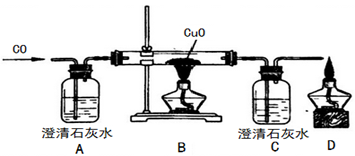
①B中反应的化学方程式是 ,该反应的还原剂是 。
②实验过程中,C中的现象是 ,D处点燃的目的是 。
③对该实验的分析正确的是 (选填编号)
a、实验结束时应先熄灭B处酒精灯
b、C中增加的质量与B中固体减少的质量相等
c、反应开始后通入0.1mol一氧化碳可生成0.1mol铜
d、反应结束后继续通入一氧化碳的目的是防止铜被氧化
④甲同学认为A装置用于证明一氧化碳不能和石灰水反应,乙同学认为省略A可达到同样的目的,理由是 。
【2015年福建省厦门市】“史上最贵”的实验:
步骤Ⅰ.让金刚石在充足的氧气中燃烧,收集生成的气体;
步骤Ⅱ.让足量镁条在步骤Ⅰ生成的气体中燃烧,生成黑色的炭粉和白色的固体氧化物。
(1)步骤Ⅱ中发生反应的化学方程式:___________________,基本反应类型是_________。
(2)若金刚石质量为m1,按上述步骤反应且转化完全,生成的炭粉质量为m2,则m1____m2(填“<”、“=”、“>”=,理由为___________________________________________。
【2015年安徽省】某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验。
(1)请写出镁条与氧气反应的化学方程式 。
(2)小明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵守质量守恒定律。
我 (“同意”或“不同意”)小明的观点,因为 。
(3)小红按下图装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体。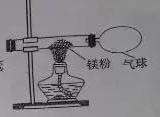
【提出问题】黄色固体是什么呢?
【查阅资料】
①氧化镁为白色固体
②镁能与氮气反应生成黄色的氮化镁(Mg3N2)固体;③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
【做出猜想】黄色固体为Mg3N2
【实验探究】请设计实验,验证猜想
| 实验操作 |
实验现象及结论 |
【反思与交流】空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的氧化镁却远多于氮化镁,为什么?请给出合理的解释 。
[注意:若答对第(4)小题奖励4分,化学试卷总分不超过60分。]
(4)该兴趣小组又做了镁条与盐溶液反应的实验,发现均能产生H2,实验现象如下:
| 实验序号 |
实验1 |
实验2 |
实验3 |
|
| 与镁条反应的溶液 |
NH4Cl |
NaCl |
Na2SO4 |
H2O |
| 实验现象 |
有大量气泡产生 |
有较多气泡产生 |
有少量气泡产生 |
气泡较少 |
| 加热后,实验现象 |
气泡明显增多, 可闻到氨味 |
气泡增多 |
气泡增多 |
气泡增多 |
上表中,用水进行实验的目的是 。
根据上表中的实验现象,请写出三条结论,并分析可能的原因(不分析原因,不得分)
①
②
③