我国化学家侯德榜先生创立的联合制碱法,将碱厂与氨厂联合,既提高效益又减少污染,促进了世界制碱工业的发展。联合制碱法的模拟流程如图一所示。
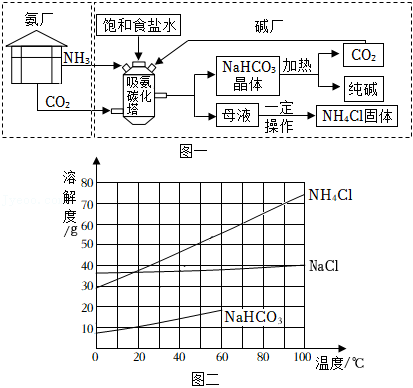
三种盐的溶解度随温度变化的曲线如图二所示。吸氨碳化塔中温度控制在30℃~35℃,其中主要发生的反应是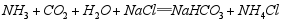 。
。
(1)氨厂的原料 来自于空气。分离液态空气是利用空气中各成分的 不同。
(2)通常状况下,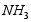 的溶解度远大于
的溶解度远大于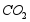 的溶解度。为了提高产率,吸氨碳化塔中应该先通入的是
的溶解度。为了提高产率,吸氨碳化塔中应该先通入的是
(填“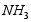 ”或“
”或“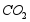 ”)。
”)。
(3)加热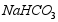 制得纯碱的化学方程式是 。
制得纯碱的化学方程式是 。
(4)结合图二分析,吸氨碳化塔中析出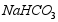 固体的主要原因是 (填序号)。
固体的主要原因是 (填序号)。
①溶剂质量减少;
②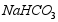 难溶于水;
难溶于水;
③30℃~35℃时,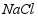 、
、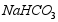 、
、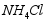 的溶解度相比较,
的溶解度相比较,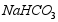 的溶解度最小,易达到饱和而析出
的溶解度最小,易达到饱和而析出
(5)氨厂生产的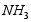 溶于水后得到的氨水可以做 肥(填化肥类别)。碱厂与氨厂联合后,用
溶于水后得到的氨水可以做 肥(填化肥类别)。碱厂与氨厂联合后,用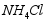 代替氨水做化肥,其优势是 (答一点即可)。
代替氨水做化肥,其优势是 (答一点即可)。
写出下列化学反应的方程式,并在括号内注明反应类型:
(1)磷在空气中燃烧()反应
(2)铜与硝酸银溶液()反应
(3)已知有可变化合价的元素形成的不同价态的单质和化合物之间可相互反应。如:C+CO2 2CO。
2CO。
现将生锈的铁钉放入一定量的稀盐酸中,可发生三个化学反应,请写出第③个化学反应方程式:①Fe+2HCl=FeCl2+H2↑;
②Fe2O3+6 HCl=2FeCl3+3H2O;
③
⑴现有四种物质:①碳酸钙②明矾 ③不锈钢 ④聚乙烯塑料,请用相应序号填空:
①用于制作医疗器械、炊具的是;②用作补钙剂的是;
③净化水时可作絮凝剂的是;④属于有机高分子材料的是。
⑵现有H、S、O、C、Na五种元素,选择合适元素,写出符合下列要求的物质的化学式:
①实验室可用来制氧气的氧化物;②厨房清洁剂里的碱;
③铅蓄电池里的酸;④能被人体直接吸收的糖。
黄铁矿的主要成分是FeS2。测定黄铁矿中FeS2含量的两种方法如下图所示: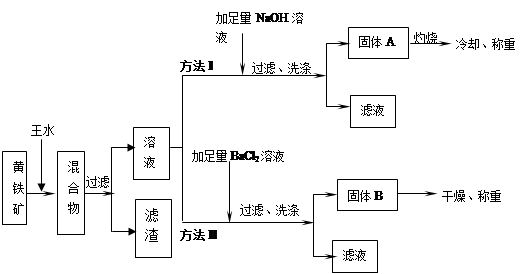
已知:王水(王水是浓盐酸和浓硝酸按体积比为3:1混合而成)与FeS2反应的化学方程式:FeS2+5HNO3+3HCl=FeCl3+2H2SO4+5NO↑+2H2O
请回答下列问题:
⑴过滤用的玻璃仪器除烧杯、玻璃棒、还有①。
⑵方法II中加足量BaCl2溶液的作用是②,写出与氯化钡反应的化学方程式③。
⑶通常黄铁矿中会含有其它金属杂质,用方法I测定黄铁矿试样中FeS2的含量时,测定结果会④。(填“偏高”“偏低”“不变”)(测定过程中由操作产生的误差可忽略。)
⑷工业上一般不直接用黄铁矿冶炼铁的原因是:⑤。
(7分)通过对化学的学习,你已经掌握了实验室制取气体的有关规律,请结合下图回答问题:
⑴写出图中标号仪器的名称a①
⑵用加热高锰酸钾的方法制取较纯净的氧气,应选用的装置组合是②(填编号)。写出高锰酸钾受热分解的化学方程式③。
⑶实验室还可以用分解过氧化氢溶液的方法制取氧气。常温下在试管中加入下列物质,把带火星的木条伸入试管中,不能使木条复燃的是④。
| A.5ml 5%的过氧化氢溶液 |
| B.5ml 5%的过氧化氢溶液和少量硫酸铜溶液 |
| C.5ml 5%的过氧化氢溶液和少量二氧化锰 |
| D.5ml 5%的过氧化氢溶液和少量红砖粉末 |
⑷如下图I是实验室“制取氢气并还原氧化铜实验”的简易装置,其中铜制燃烧匙可以在试管M中上下移动,虚线框中的装置需从图Ⅱ中选取.图Ⅱ中的细铜丝一端绕成螺旋状,先在酒精灯火焰上加热,变黑后再趁热迅速地伸到制得的氢气中.请回答下列问题:
a.在图I中,试管M内的液体应选用⑤
b.在图I的虚线框中,应选用图Ⅱ中的⑥(填“A”或“B”)装置,
c.上述制氢气的方法与锌粒直接加入试管中相比,其主要优点是⑦.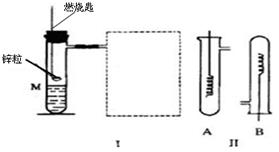
(5分)根据要求写出下列方程式,并注明基本反应类型。
⑴用稀盐酸除铁锈_________()反应
⑵氢氧化铜加热生成两种氧化物__ ______( )反应
⑶甲烷燃烧______________________