下列有关元素单质或化合物的叙述正确的是( )
| A. |
分子呈正四面体,键角为 |
| B. |
焰色试验为黄色,与 电子跃迁有关 |
| C. |
基态原子核外电子排布符合构造原理 |
| D. |
是由极性键构成的极性分子 |
已知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似,如下: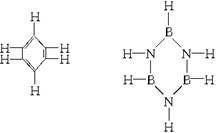
则硼氮苯的二氯取代物B3N3H4Cl2的同分异构体的数目为( )
| A.2种 | B.3种 | C.4种 | D.6种 |
苯甲酸钠是常用的食品防腐剂,其结构简式为 ,以下对苯甲酸钠描述错误的是( )
,以下对苯甲酸钠描述错误的是( )
| A.属于盐类 | B.能溶于水 |
| C.属于烃类 | D.不易分解 |
已知分子式为C12H12的物质A的结构简式为 ,A苯环上的二溴代物有九种同分异构体,由此推断A苯环上的四溴代物的异构体的数目有( )
,A苯环上的二溴代物有九种同分异构体,由此推断A苯环上的四溴代物的异构体的数目有( )
| A.9种 | B.10种 | C.11种 | D.12种 |
下列各组有机物中,只需加入溴水就能一一鉴别的是( )
| A.己烯、苯、四氯化碳 |
| B.苯、己炔、己烯 |
| C.己烷、苯、环己烷 |
| D.甲苯、己烷、己烯 |
2005年11月吉林某化工厂发生爆炸,大量苯类物质进入松花江,其中以硝基苯的危害最大。以下对硝基苯污染认识正确的有 …( )
①硝基苯不稳定,能在短时间内挥发而消除②硝基苯是有毒物质,会造成大量水生生物死亡③硝基苯难溶于水,会沉入水底,在河泥中积累④硝基苯和活性炭发生化学反应生成没有毒性的物质
| A.①② | B.③④ | C.①④ | D.②③ |