用可再生能源电还原CO2时,采用高浓度的K+抑制酸性电解液中的析氢反应来提高多碳产物(乙烯、乙醇等)的生成率,装置如图所示。下列说法正确的是( )

| A. |
析氢反应发生在IrOx﹣Ti电极上 |
| B. |
Cl﹣从Cu电极迁移到IrOx﹣Ti电极 |
| C. |
阴极发生的反应有:2CO2+12H++12e﹣═C2H4+4H2O |
| D. |
每转移1mol电子,阳极生成11.2L气体(标准状况) |
海水是巨大的资源宝库,下列说法正确的是
| A.碘元素又称“海洋元素” |
| B.镁是海水中含量最多的金属元素 |
| C.从海水中提取食盐和碘的过程都是物理变化 |
| D.氯碱工业和纯碱工业的原料都有食盐 |
如图是草酸溶液中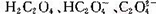 三种微粒的分布分数(某微粒物质的量浓度与三种微粒物质的量浓度和的比值)与pH的关系,下到有关说法不正确的是
三种微粒的分布分数(某微粒物质的量浓度与三种微粒物质的量浓度和的比值)与pH的关系,下到有关说法不正确的是
A.pH=5的溶液中:  |
B.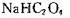 溶液中: 溶液中: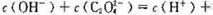  |
C.向 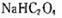 溶液中加强酸至pH与a点对应时,溶液中 溶液中加强酸至pH与a点对应时,溶液中  |
D.为使溶液中c(  )尽可能多一些,溶液的pH最好控制在2.7左右 )尽可能多一些,溶液的pH最好控制在2.7左右 |
钴的氧化物广泛应用于磁性材料及超导材料等领域。取一定量的钴的氧化物(其中钴的化合价为+2、+3价),用480 mL 5 mol·L-1盐酸恰好完全溶解固体,得到CoCl2溶液和4.48L(标准状况)黄绿色气体。通过计算可以确定该氧化物中Co、O的物质的量之比为
| A.1:1 | B.2:3 | C.3:4 | D.5:6 |
已知,某无色溶液中含有下列离子中的几种: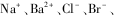
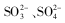 ,为了确定溶液的组成,某学生进行如下探究实验:
,为了确定溶液的组成,某学生进行如下探究实验:
①用pH试纸检测溶液的酸碱性,溶液的pH大于7
②取少量溶液,向其中滴加氯水,再加入CC14振荡,静置,CC14呈橙黄色
③另取少量溶液,向其中滴加Ba(NO3)2溶液和稀HNO3,有白色沉淀产生
④用分液漏斗将②所得混合液分离,倒出上层清液,滴加AgNO3溶液和稀HNO3,有白色沉淀产生。
根据上述实验判断,下列结论正确的是
A.溶波中一定含有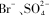 ' ' |
| B.溶液一定含有Na+,不含Ba2+ |
| C.实验①与上述离子的检验没有关系,可以省略 |
| D.由实验④可以判断溶液中含有Cl- |
山萘酚(Kaempf erol)结构如下图所示,且大量存在于水果、蔬菜、豆类、茶叶中,具有多种生物学作用,如抗氧化、抑制肿瘤生长及保护肝细胞等作用。下列有关山萘酚的叙述正确的是
| A.结构式中含有羟基、醚键、酯基、碳碳双键 |
| B.可发生取代反应、水解反应、加成反应 |
| C.可与NaOH反应,不能与NaHCO3反应 |
| D.1 mol山萘酚与溴水反应最多可消耗4 mol Br2 |