反应 应用于石油开采。下列说法正确的是( )
| A. |
的电子式为 |
| B. |
中N元素的化合价为 |
| C. |
分子中存在 键 |
| D. |
为非极性分子 |
若将反应:Zn+H2SO4= ZnSO4+H2↑设计成原电池(装置如右),
则下列说法正确的是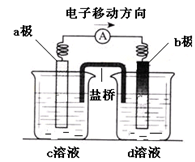
| A.d溶液是稀硫酸 |
| B.c溶液颜色变蓝 |
| C.b极发生氧化反应 |
| D.a极是铜棒 |
关于海带中提取碘实验,下列说法正确的是
| A.实验中包含溶解、过滤、升华等步骤 |
| B.加入过量的氯水将I-全部氧化成I2 |
| C.可以用CCl4直接将海带中的碘元素萃取出来 |
| D.将海带灼烧的目的是除掉其中的有机物,将碘元素转化为I- |
下列说法不正确的是
| A.明矾净水的原理是Al3+水解产生Al(OH)3胶体,Al(OH)3胶体能吸附水中的悬浮杂质,并使之沉降 |
| B.摩尔盐的制备原理为:6H2O+FeSO4+(NH4)2SO4=(NH4)2Fe(SO4)?6H2O,反应之所以能进行的原因是(NH4)2Fe(SO4)?6H2O溶解度最小 |
| C.镀锌铁皮在酸中溶解,当镀层反应完全时,产生氢气的速率会突然减慢 |
| D.将火柴头直接浸入品红溶液中,可以检验火柴头中是否含有硫元素 |
下列说法不正确的是
| A.增大压强,活化分子百分数不变,化学反应速率增大 |
| B.升高温度,活化分子百分数增大,化学反应速率增大 |
| C.增大反应物浓度,活化分子百分数增大,化学反应速率增大 |
| D.使用催化剂,活化分子百分数增大,化学反应速率增大 |
下列仪器使用方法错误的是
| A.分液漏斗使用前需检查是否漏液 |
| B.减压过滤实验结束后,应先拆下连接抽气泵和吸滤瓶的橡皮管,然后关闭水龙头 |
| C.坩埚可直接加热,不需要垫石棉网 |
| D.蒸馏时温度计水银球应该插入液面以下 |