阅读下列材料,完成下面小题。
氢元素及其化合物在自然界广泛存在且具有重要应用。 、
、 、
、 是氢元素的3种核素,基态
原子
的核外电子排布,使得
既可以形成
又可以形成
,还能形成
等重要化合物;水煤气法、电解水、光催化分解水都能获得
,如水煤气法制氢反应中,
与足量
反应生成
和
吸收
的热量。
在金属冶炼、新能源开发、碳中和等方面具有重要应用,如
在催化剂作用下与
反应可得到
。我国科学家在氢气的制备和应用等方面都取得了重大成果。
是氢元素的3种核素,基态
原子
的核外电子排布,使得
既可以形成
又可以形成
,还能形成
等重要化合物;水煤气法、电解水、光催化分解水都能获得
,如水煤气法制氢反应中,
与足量
反应生成
和
吸收
的热量。
在金属冶炼、新能源开发、碳中和等方面具有重要应用,如
在催化剂作用下与
反应可得到
。我国科学家在氢气的制备和应用等方面都取得了重大成果。
(1)下列说法正确的是( )
| A. |
|
| B. |
和 的中心原子轨道杂化类型均为 |
| C. |
分子中的化学键均为极性共价键 |
| D. |
晶体中存在 与 之间的强烈相互作用 |
(2)下列化学反应表示正确的是( )
| A. |
水煤气法制氢: |
| B. |
催化加氢生成
的反应:
|
| C. |
电解水制氢的阳极反应: |
| D. |
与水反应: |
(3)下列物质结构与性质或物质性质与用途具有对应关系的是( )
| A. |
具有还原性,可作为氢氧燃料电池的燃料 |
| B. |
氨极易溶于水,液氨可用作制冷剂 |
| C. |
分子之间形成氢键, 的热稳定性比 的高 |
| D. |
中的 原子与 形成配位键, 具有还原性 |
下列说法正确的是
| A.铅蓄电池放电时的负极和充电时的阳极均发生还原反应 |
| B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
C.N2(g)+3H2(g) 2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大 2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大 |
| D.纯碱溶于热水中去污效果增强,说明纯碱的水解是放热反应 |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.1 L 0.1mol·L-1的氨水含有0.1NA个OH- |
| B.1 L 1 mol·L-1的NaClO溶液中含有ClO-的数目为NA |
| C.在电解精炼粗铜的过程中,当阴极析出32 g铜时转移电子数为NA |
| D.25℃时,pH =13的Ba(OH)2溶液中含有OH-的数目为0 .1 NA |
常温下,下列溶液中各组离子一定能大量共存的是
| A.使甲基橙呈红色的溶液中:Na+、AlO2-、NO3-、CO32- |
| B.由水电离产生的c(H+)=10-12mol·L-1的溶液:NH4+、SO42-、HCO3-、Cl- |
| C.c(H+)/c(OH-)= 1×1014的溶液: Ca2+、Na+、ClO-、NO3- |
D.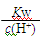 =0.1 mol·L-1的溶液:Na+、K+、CO32-、NO3- =0.1 mol·L-1的溶液:Na+、K+、CO32-、NO3- |
下列物质的系统命名中,错误的是
A.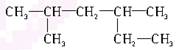 2,4-二甲基己烷 2,4-二甲基己烷 |
B.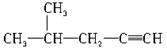 2-甲基-4-戊炔 2-甲基-4-戊炔 |
C.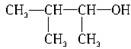 3-甲基-2-丁醇 3-甲基-2-丁醇 |
| D.CH3—CHBr—CHBr—CH3 2,3-二溴丁烷 |
分子式为C7H16的烷烃中,含有3个甲基的同分异构体的数目是
| A.2 | B.3 | C.4 | D.5 |