按要求书写下列热化学方程式
(1)N2(g)和H2(g)反应生成1molNH3(g)放出46.1KJ热量
(2)航天领域使用氢氧燃烧电池有酸式和碱式两种,它们放电时的总反应可以表示为2H2 + O2 =2H2O,酸式氢氧燃烧电池的电解池是酸。其负极反应可以表示为2H2-4e-=4H+,则其正极反应可以表示为; ;碱式氢氧燃烧电池的电解质是碱,其正极反应可以表示为:O2+2H2O+4e-=4OH-,则其负极反应可以表示为: 。
(3)用石墨作电极电解NaCl水溶液
阳极的电极反应 ,阴极的电极反应
(4)在粗铜精炼的反应中
当阳极,发生 (填“氧化”或“还原”)反应,
阳极的电极反应
(5)将H+、Cu2+、SO42-、Cl-五种离子组成电解质按要求进行电解:以碳棒为电极,使电解质质量减少,水量不变进行电解,应采用的电解质是 、 ;
化学工作者十分关注聚氯乙烯(PVC)保鲜膜的安全问题。PVC保鲜膜的安全隐患主要来自于塑料中残留的PVC单体以及不符合国家标准的增塑剂DEHA。
(1)工业上用乙烯和氯气为原料经下列各步合成PVC:
乙是PVC的单体,其结构简式为__________________________________________________,
反应①③的化学方程式分别为__________________________________________________、
________________________________________________________________________。
(2)邻苯二甲酸辛酯(DOP)是国家标准中允许使用的增塑剂之一,邻苯二甲酸酐(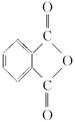 )是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂DMP(分子式为C10H10O4),DMP属于芳香酸酯,其结构简式为
)是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂DMP(分子式为C10H10O4),DMP属于芳香酸酯,其结构简式为
________________________________________________________________________。
现有下列高分子化合物,请从下列各项中选择出最恰当的选项,将代号填入下表。
(1)高分子结构型式示意图: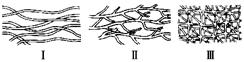
(2)高分子材料的主要性质特点:
| A.具有热塑性 |
| B.可溶于有机溶剂 |
| C.不溶于有机溶剂 |
| D.具有确定的熔点 |
(3)主要应用:(a)用于制备塑料薄膜;(b)用于制备光学仪器;(c)用于制备车辆轮胎
| 硫化橡胶 |
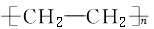 |
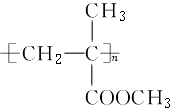 |
|
| (1) |
|||
| (2) |
|||
| (3) |
有机玻璃是日常使用较多的化工产品,用下面的流程可以合成有机玻璃(聚甲基丙烯酸甲酯):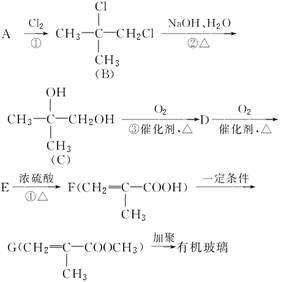
根据上述过程回答下列问题:
(1)A的名称:__________________;写出E的结构简式:________________。
(2)写出上述过程中的反应类型:
②_______________,④________________。
(3)写出③的化学方程式___________________________________。
(4)任写一个G的属于酸的同分异构体的结构简式:
________________________________________________________________________。
某厂以甘蔗为原料制糖,对产生的大量甘蔗渣按下图所示转化进行综合利用。其中B是A水解的最终产物;C的分子式为C3H6O3,一定条件下2个C分子间脱去2个水分子可生成一种六元环状化合物;D可使溴水褪色;H的三聚合物I也是一种六元环状化合物(图中部分反应条件及产物没有列出)。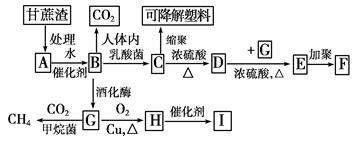
(1)写出下列物质的结构简式:
高分子化合物F________;六元环状化合物I________________________________。
(2)C→D的反应类型为________。D→E的反应类型为________。
(3)写出下列反应的化学方程式:
A→B:________________________________________________________________________。
C→可降解塑料:______________________________________________________________。
(4)H分子所含官能团的名称是________,实验室中常用于检验该官能团的试剂的名称是(只写一种)______________________。
(5)G转变成CH4的反应曾做过如下的同位素示踪实验(D、T为H的同位素):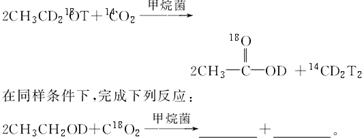
用16.2 g脱脂棉(设为纯纤维素)制得25.2 g硝酸纤维。该硝酸纤维的结构简式为________________________________________________________________________。