强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)==H2O ( l)
ΔH=-57.3 kJ / mol,分别向1 L 0.5 mol / L的NaOH溶液中加入:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应时热效应分别为ΔH1、ΔH2、ΔH3,它们的关系正确的是
| A.ΔH1>ΔH2>ΔH3 | B.ΔH1<ΔH3<ΔH2 |
| C.ΔH1=ΔH2=ΔH3 | D.ΔH2<ΔH3<ΔH1 |
在合成氨时,可以提高H2转化率的措施是()
| A.延长反应时间 | B.充入过量H2 | C.充入过量N2 | D.升高温度 |
合成氨所需的H2可由煤和水蒸气反应而制得,其中一步的反应为:
CO+H2O(g) CO2+H2(正反应放热),下列措施中,能提高CO转化率的是()
CO2+H2(正反应放热),下列措施中,能提高CO转化率的是()
| A.增大压强 | B.降低温度 | C.增大水蒸气浓度 | D.增大CO浓度 |
在合成氨工业中,为增加氨的日产量,下列变化过程中不能使平衡向右移动的是()
| A.不断将氨分离出来 | B.使用催化剂 |
C.采用500 C左右的温度 C左右的温度 |
D.采用10~30MPa的压强 |
关于氨的合成工业的下列说法正确的是()
| A.从合成塔出来的气体,其中氨气一般占15%,所以生产氨的工业的效率都很低 |
| B.由于NH3易液化,N2、H2可循环使用,则总的说来氨的产率很高 |
| C.合成氨工业的反应温度控制在400~500 ℃左右,目的是使平衡向正反应方向进行 |
| D.合成氨工业采用10MPa~30MPa ,是因该条件下催化剂的活性最好 |
对于可逆反应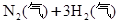

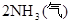
 H<0,下列说法正确的是()
H<0,下列说法正确的是()
| A.达到平衡时反应物和生成物浓度一定相等 |
| B.达到平衡后加入氨气,重新达到平衡时,氨气的浓度比原平衡时增大 |
| C.达到平衡时,升高温度加快了吸热反应的速率,降低了放热反应的速率,所以反应向逆反应的速率移动 |
| D.加入催化剂可以缩短到达平衡的时间,这是因为加快了正反应的速率,而减慢了逆反应的速率 |