实验室制备1,2—二溴乙烷的反应原理如下:CH3CH2OH  CH2=CH2,CH2=CH2+Br2
CH2=CH2,CH2=CH2+Br2 BrCH2CH2Br。用少量的溴和足量的乙醇制备l,2—二溴乙烷的装置如下图所示:
BrCH2CH2Br。用少量的溴和足量的乙醇制备l,2—二溴乙烷的装置如下图所示:
有关数据列表如下:
| |
乙醇 |
1,2—二溴乙烷 |
乙醚 |
| 状态 |
无色液体 |
无色液体 |
无色液体 |
| 密度/g·cm-3 |
0.79 |
2.2 |
0.71 |
| 沸点/℃ |
78.5 |
132 |
34.6 |
| 熔点/℃ |
-130 |
9 |
-116 |
回答下列问题:
(1)在装置c中应加入 (选填序号),其目的是吸收反应中可能生成的酸性气体。
①水 ②浓硫酸 ③氢氧化钠溶液 ④饱和碳酸氢钠溶液
(2)判断d管中制备二溴乙烷反应已结束的最简单方法是 。
(3)将二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在水的 (填“上”或“下”)层。
(4)若产物中有少量未反应的Br2,最好用 (填正确选项前的序号)洗涤除去。
①水 ②氢氧化钠溶液 ③碘化钠溶液 ④乙醇
(5)反应过程中需用冷水冷却(装置e),其主要目的是 ;但不用冰水进行过度冷却,原因是: 。
(6)以1,2—二溴乙烷为原料,制备聚氯乙烯,为了提高原料利用率,有同学设计了如下流程:1,2—二溴乙烷通过( ① )反应制得( ② ),②通过( ③ )反应制得氯乙烯,由氯乙烯制得聚氯乙烯。
①______________(填反应类型)
②________________(填该物质的电子式)
③______________(填反应类型)
写出第一步的化学方程式_________________。
如图是某同学在实验室中进行铝热反应(铝过量)的实验装置,实验中可观察到的现象之一为“纸漏斗的下部被烧穿,有熔融物落入沙中”。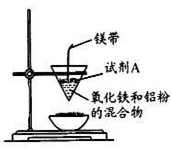
(1)试剂A的名称是。
(2)反应的方程式为。
(3)探究铝热反应后固体的性质:将反应后容器中的残余固体置于烧杯中,加入100mL稀硝酸,固体完全溶解,(假设固体全部溶解后溶液体积不变),反应过程中无气体放出(活泼金属可把稀 HNO3还原为NH4NO3)。向反应后的溶液中缓慢滴加4 mol·L-1的NaOH溶液,产生沉淀的物质的量与加入 NaOH溶液 的体积的关系如图所示: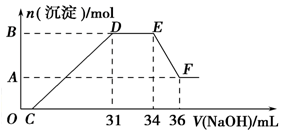
①写出DE段发生反应的离子方程式:________________。
②求c(HNO3)=。
③B与A的差值为________________。
空气吹出法是最早工业上海水提溴的方法,适合从低浓度含溴溶液提取溴。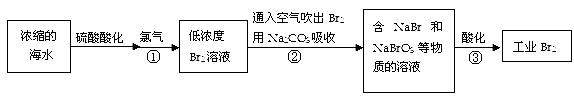
(1)Br2单质的颜色为,NaBr的电子式是。
(2)反应①是将Br— 转化为Br2,则反应①的离子方程式是。
(3)通入空气吹出Br2,并用Na2CO3吸收的目的是。
(4)反应③的离子方程式是,每生成3 mol Br2,转移电子的物质的量是mol。
(5)为了除去工业Br2中微量的Cl2,可向工业Br2中(填字母)。
a.通入HBrb.加入NaBr溶液
c.加入Na2CO3溶液d.加入Na2SO3溶液
实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的相关数据如下表:
| 化合物 |
相对分子质量 |
密度/g·cm-3 |
沸点/℃ |
溶解度g/l00g水 |
| 正丁醇 |
74 |
0.80 |
118.0 |
9 |
| 冰醋酸 |
60 |
1.045 |
118.1 |
互溶 |
| 乙酸正丁酯 |
116 |
0.882 |
126.1 |
0.7 |
操作如下:
①在50mL三颈烧瓶中投入几粒沸石,将18.5 mL正丁醇和13.4 mL冰醋酸(过量),3~4滴浓硫酸按一定顺序均匀混合,安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管。
②将分水器分出的酯层和反应液一起倒入分液漏斗中依次用水洗,10% Na2CO3洗,再水洗,最后转移至锥形瓶并干燥。
③将干燥后的乙酸正丁酯加入烧瓶中,常压蒸馏,收集馏分,得15.1 g乙酸正丁酯。
请回答有关问题:
(1)写出任意一种正丁醇同类的同分异构体的结构简式。
(2)仪器A中发生反应的化学方程式为。
(3)步骤①向三颈烧瓶中依次加入的药品是:。
(4)步骤②中,用 10%Na2CO3溶液洗涤有机层,该步操作的目的是。
(5)步骤③在进行蒸馏操作时,若从118℃开始收集馏分,产率偏,(填“高”或“低”)原因是。
(6)该实验生成的乙酸正丁酯的产率是。
为测定已变质的过氧化钠的纯度,设计如下图所示的实验;Q为一具有良好的弹性气球,称取一定量的样品放于其中,按图安装的实验装置打开分液漏斗的活塞,将稀H2SO4滴入气球中。请填空:
(1)Q内发生反应生成_________种气体,其中的反应有_________个氧化还原反应。
(2)为测定反应生成气体的总体积,滴稀H2SO4前必须关闭(填K1、K2或K3,下同)_________,打开_________。
(3)当上述反应停止,将K1、K2、K3处于关闭状态,然后先打开K2,再缓缓打开K1,这时可观察到的现象是_________。
(4)导管a的作用是_________。
(5)b中装的固体试剂是_________,为何要缓缓打开K1_________。
(6)实验结束时量筒I中有x mL水,量筒II中收集到y mL气体,则过氧化钠的纯度是_________(体积折算到标准状况)。
用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166 g·mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术。ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是> > 。(填化学式)
(2)二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生用如上图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置。请问:
①A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式:。
A部分还应添加温度控制(如水浴加热)装置,B部分还应补充什么装置:;
②该装置按①补充完整后,装置A、B、C中还有一处设计明显不合理的是(填“A、B或C”),理由是。
③C中的试剂为NaOH溶液,反应时生成氯酸钠和亚氯酸钠(NaClO2),该反应的离子方程式为。若实验时需要450mL 4mol/L的NaOH溶液,则在精确配制时,需要称取NaOH的质量是g,所使用的仪器除托盘天平、量筒、胶头滴管、玻璃棒外,还必须有。