已知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:NH 、Ba2+、Na+、H+、SO
、Ba2+、Na+、H+、SO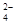 、NO
、NO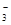 、OH-、CO
、OH-、CO 。将这四种溶液分别标记为A、B、C、D,进行如下实验:
。将这四种溶液分别标记为A、B、C、D,进行如下实验:
①在A或D中滴入C,均有沉淀生成
②D和B反应生成的气体能被A吸收
③A和D反应生成的气体能被B吸收
试回答下列问题:
(1)D的化学式是
(2)写出B物质的化学式:
(3)写出实验②中有关反应的离子方程式
。
常温常压下,用等质量的氢气、甲烷、氧气、二氧化碳四种气体分别吹出四个气球,其中气体为甲烷的是:
5.4 g M和16.0 g N恰好完全反应,生成0.2 mol X和10.2 g Y,则X的摩尔质量为
| A.56 | B.56 g·mol -1 | C.28 | D.28 g·mol -1 |
相等物质的量的H2O和H2O2相比较,下列有关叙述中正确的是
①它们所含的分子数目之比为1∶1 ②它们所含的原子总数目之比为3∶4 ③它们所含的O原子数目之比为1∶2 ④它们所含的H原子数目之比为1∶1 ⑤它们所含的质子数目之比为5∶9
| A.①②③ | B.③④⑤ | C.①②④ | D.①②③④⑤ |
能表示阿伏加德罗常数数值的是
| A.1 mol金属钠含有的电子数 |
| B.1 L 1 mol/L硫酸溶液所含的H+数 |
| C.标准状况下,22.4 L四氯化碳所含的分子数 |
| D.0.012 kg 12C所含的原子数 |
下列物质在水溶液中的电离方程式不正确的是
| A.Ca(OH)2 ═ Ca2++2OH- |
| B.Al2(SO4)3 ═ 2Al3++3SO42- |
| C.NH4Cl = NH3 + H++OH- |
| D.HNO3 = H++NO3- |