我国拥有世界上最大的稀土矿,品位甚高。以RE表示稀土元素,可以向含RE的硫酸盐溶液中加入粉状Na2SO4使稀土元素转为沉淀,反应为
|
RE2(SO4)3+Na2SO4+xH2O====RE2(SO4)3·Na2SO4·xH2O↓ (x=1,2,3),下列叙述正确的是
( )
| A.该反应为复分解反应 | B.该反应一定在强碱性溶液中进行 |
| C.产生的沉淀物属于复盐 | D.产生的沉淀物一定是难溶物质 |
“信息”、“材料”和“能源”被称为新科技革命的三大支柱。下列有关说法错误 的是
的是
| A.在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 |
| B.目前中、美、日等国掌握的陶瓷发动机技术,大大提高了发动机的能量转化效率 |
| C.2011年9月29日成功发射的“天宫一号”目标飞行器使用了大量的复合材料 |
| D.合成高分子材料的广泛应用是有百利而无一害 |
下列叙述正确的是( )
| A.从HF、HCl、HBr、HI的酸性递增的事实,推出F、Cl、Br、I的非金属性递增的规律 |
| B.N的非金属性比P强,N2的活动性比磷单质的强 |
| C.Li、Na、K的原子半径和单质密度随原子序数的增加而增大 |
| D.从氢硫酸露空放置容易变质,产生浑浊的事实,推出O的非金属性比S强 |
下列离子方程式书写正确的是( )
| A.Na2O2与水反应 2O 22-+ 2H2O =O2↑+ 4OH- |
| B.过量CO2通入Ca(ClO)2溶液中ClO-+CO2+H2O = HCO3-+HClO |
| C.向Na2CO3溶液中加入过量CH3COOH溶液CO32-+2H+= CO2↑+H2O |
| D.向Ba(OH)2溶液中加入少量NaHSO3溶液2HSO3-+Ba2++2OH-= BaSO3↓+SO32-+2H2O |
下列做法中用到物质氧化性的是( )
| A.氮气作为填充气 | B.纯碱除去 油污 油污 |
| C.双氧水消毒 | D.SO2作为一些纸张的漂白剂 |
下列实验过程中,始终无明显现象的是( )
A. 通入 通入 溶液中 溶液中 |
B. 通入已酸化的 通入已酸化的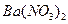 溶液中 溶液中 |
| C.一充满NO2试管倒扣在水中 | D.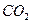 通入 通入 溶液中 溶液中 |