X、Y、Z三种元素的原子,其最外层电子排布为ns1,3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是
| A.X2YZ3 | B.X2YZ2 | C.XYZ2 | D.XYZ3 |
化学与生产、生活、社会密切相关。下列有关说法中,错误的是
| A.服用铬含量超标的药用胶囊会对人体健康造成危害 |
| B.血液透析是利用了胶体的性质 |
| C.在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 |
| D.厨房中燃气泄漏,立即打开抽油烟机排气 |
铁粉和铜粉的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):
| 编号 |
① |
② |
③ |
④ |
| 稀硝酸体积/mL |
100 |
200 |
300 |
400 |
| 剩余金属/g |
18.0 |
9.6 |
0 |
0 |
| NO体积/mL |
2240 |
4480 |
6720 |
V |
下列计算结果正确的是 ( )
A.①中溶解了5.6gFe B.硝酸的浓度为0.4mol/L
C.②中溶解了9.6gCuD.④中V=8960
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是()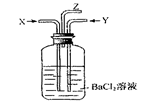
A.洗气瓶中产生的沉淀是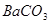 |
B.在Z导管出来的气体中无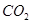 |
C.洗气瓶中产生的沉淀是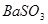 |
| D.在Z导管口有红棕色气体出现 |
下列表示对应化学反应的离子方程式正确的是()
| A.漂白粉溶液在空气中失效:ClO—+CO2+H2O=HClO+HCO3— |
| B.用KIO3氧化酸性溶液中的KI: 5I-+IO3-+3H2O =3I2+6OH- |
| C.氯化铁溶液与铜反应:Fe3++Cu=Fe2++Cu2+ |
| D.0.01 mol·L—1 NH4Al(SO4)2溶液与0.02 mol·L—1 Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH—=2BaSO4↓+Al(OH)3↓+NH3·H2O |
在容积为2 L的3个密闭容器中发生反应3A(g)+B(g) xC(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
xC(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
3 mol A、2 mol B |
6 mol A、4 mol B |
2 mol C |
| 到达平衡的时间(min) |
5 |
8 |
|
| A的浓度(mol/L) |
c1 |
c2 |
|
| C的体积分数 |
w1 |
w3 |
|
| 混合气体密度(g/L) |
ρ1 |
ρ2 |
下列说法正确的是()
A.若x<4,则2c1<c2
B.若w3=w1,可断定x=4
C.无论x的值是多少,均有2ρ1=ρ2
D.容器甲中反应从开始到达平衡平均速率为v(A)=0.3 mol·L-1·min-1