固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列是有说法中,不正确的是( )
| A.1molNH5中含有5NA个N—H键(NA表示阿伏加德罗常数) |
B.NH5中既有共价键又有离子键 H H |
| C.NH5的电子式为:[H:N:H]+[:H]- H |
| D.它与水的反应的离子方程式为:NH4++H-+H2O=NH3·H2O+H2↑ |
咖啡酸可用作化学原料和中间体,其结构如右图。下列关于咖啡酸说法不正确的是()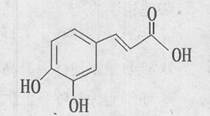
| A.能发生加聚反应 |
B.能使高锰酸钾酸性溶液 褪色 褪色 |
| C.1mol咖啡酸最多能与3 mol NaOH反应 |
| D.1mol咖啡酸最多能与3 mol Br2反应 |
下列反应的离子方程式正确的是()
| A.用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑ |
| B.向AlCl3溶液中加入过量的浓氨水:Al3++4NH3·H2O=A1O2-+4NH4++2H2O |
C.向苯酚钠溶液中通入少量 |
| D.等体积、等浓度的Ba(OH)2稀溶液与NH3HCO,稀溶液混合: |
Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3·H2O+H2O
用NA表示阿伏加德罗常数。下列说法正确的是()
| A.标准状况下,22.4 L己烷中共价键数目为19NA |
| B.1L 1mol/L FeCl3溶液中含有NA个Fe3+ |
| C.由CO2和O2组成的混合物中共有NA个分子,其中氧原子数为2NA |
| D.足量C12与5.6g Fe完全反应时,转移的电子数为0.2NA |
化学与生活密切相关,下列说法不正确的是()
| A.聚氯乙烯不能做食品包装袋 |
| B.一般情况下,合金的熔点比各成分金属的低,硬度比纯金属大 |
| C.植物通过光合作用将CO2转化为糖是太阳能转变成热能的过程 |
| D.对于酸性废水和碱性废水一般可以采用中和法处理,高浓度的酸、碱废水,应优先考虑回收利用 |
T℃时,在1 L的密闭容器中充入2 mol CO2和6mol H2,一定条件下发生反应:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g)△H=-49.0kJ/mol
CH3OH(g)+H2O(g)△H=-49.0kJ/mol
测得H2和CH3OH(g)的浓度随时间变化如右图所示。下列说法不正确的是()
| A.0~10min内v(H2)=0.3mol/(L·min) |
B.T℃时,平衡常数 ,CO2和H2的转化率相等 ,CO2和H2的转化率相等 |
| C.T℃时,上述反应中有64g CH3OH生成,同时放出98.0kJ的热量 |
| D.达到平衡后,升高温度或再充入CO2气体,都可以提高H2的转化率 |