医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量、、等杂质)生产医药级二水合氯化钙(的质量分数为97.0%~103.0%)的主要流程如下:

(1)除杂操作是加入氢氧化钙,调节溶液的为8.0~8.5,以除去溶液中的少量、。检验是否沉淀完全的实验操作是。
(2)酸化操作是加入盐酸,调节溶液的为4.0,其目的有:①将溶液中的少量转化为;②防止在蒸发时水解;③。
(3)测定样品中含量的方法是:
a.称取0.7500样品,溶解,在250容量瓶中定容;
b.量取25.00待测液于锥形瓶中;
c.用0.05000 溶液滴定至终点,消耗溶液体积的平均值为20.39。
①上述测定过程中需用溶液润洗的仪器有:。
②计算上述样品中的质量分数为:。
③若用上述方法测定的样品中的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有:;。
现有一种有机物A,分子式为C4H6O6。对于A的结构与性质实验结论如下:
i:A的分子中有两个羧基;
ii:A的核磁共振氢谱如下图所示;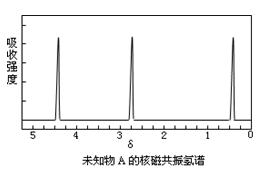
下图是利用烃B和烃I合成有机物A和一种高分子新材料R的转化关系示意图,已知烃I的相对分子质量为28,且F的相对分子质量比E多28。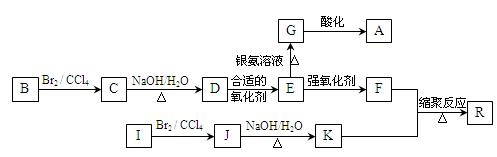
已知: 
②同一个碳原子上连有多个羟基的结构极不稳定,不予考虑。
请分析并按要求回答下列问题:
(1)写出A对应的结构简式:;
(2)写出对应反应的化学方程式:
C→D:;反应类型为:______________________;
E→G:;
F+K→R:;
(3)有机物E的同分异构体M满足下列三个条件:
①1 mol有机物与银氨溶液充分反应生成2 mol Ag
②1 mol有机物与足量NaHCO3溶液反应产生1 mol CO2
③1 mol有机物与足量金属Na反应产生1 mol H2
请判断M的结构可能有种,任写一种M的结构简式。
下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构。
回答下列问题:
(1)血红素中含有C、H、O、N、Fe五种元素,C、H、N、O四种元素的电负性由小到大的顺序是 ,根据以上电负性请判断H2N-CHO 中C和N的化合价分别为 和 。写出基态Fe原子的核外价电子排布图 。
(2)血红素中两种N原子的杂化方式分别为 ,在上图乙的方框内用“→”标出Fe2+的配位键。
(3)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为 ,δ、α两种晶胞中铁原子的配位数之比为 ;在δ晶胞中空间利用率为____________,其晶体的堆积方式的名称为 ,与其具有相同堆积方式的金属还有 (填元素符号)。
I.描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb)。表1
| 酸或碱 |
电离平衡常数(Ka或 Kb) |
| CH3COOH |
1.8×10-5 |
| HNO2 |
4.6×10-4 |
| HCN |
5×10-10 |
| HClO |
3×10-8 |
| NH3·H2O |
1.8×10-5 |
请回答下列问题:
(1)上述四种酸中,酸性最弱的是 (用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是 (填序号)。
| A.升高温度 | B.加水稀释 | C.加少量的CH3COONa固体 | D.加少量冰醋酸 |
(2)CH3COONH4的水溶液呈 (选填“酸性”“中性”或“碱性”),理由是:
,
溶液中各离子浓度大小的关系是 。
II.氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:(图中涉及物质为气态)
(1)上图是1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 。
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:
N2(g)+3H2(g) 2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:请完成下列问题。
2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:请完成下列问题。
| t/℃ |
200 |
300 |
400 |
| K |
K1 |
K2 |
0.5 |
①试比较K1、K2的大小,K1_ K2(填写“>”、“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是____(填序号字母):
a.容器内N2、H2、NH3的浓度之比为1:3:2b.v(N2)正=3v(H2)逆
c.容器内压强保持不变d.混合气体的密度保持不变
③在400℃时, 当测得NH3和N2、H2的物质的量分别为1mol和2mol、3mol时,则该反应的v(N2)正_ _ v(N2)逆(填写“>”、“=”或“<”)
有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。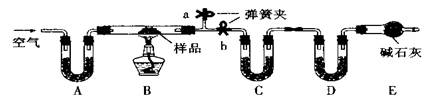
(1)实验时,B中发生反应的化学方程式为 , 。
(2)装置C、D中盛放的试剂分别为:
C ,D (供选试剂为:浓硫酸、无水CaCl2、碱石灰)
(3)E装置中的仪器名称是 ,它在该实验中的主要作用是
(4)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将 (填“偏高”、“偏低”或“无影响”)。
(5)反应前,在B装置中通入空气可减少实验误差,操作方法是 。
(6)若样品的质量为m g,反应后C、D的质量差分别为m1g、m2g,则该混合物中Na2CO3·10H2O的质量分数为: 。
(18分) 下图中A、B、C、D、E、F、G均为有机化合物。
下图中A、B、C、D、E、F、G均为有机化合物。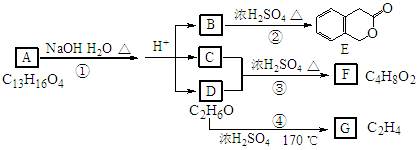
根据上图回答问题:
(1) D的化学名称是_____________。
(2) 反应③的化学方程式是(有机物须用结构简式表示)
(3)B的分子式是,所含官能团名称为。A的结构简式是。反应①的反应类型是_____________。
(4)符合下列3个条件的B的同分异构体的数目有_______个。
①含有邻二取代苯环结构;②与B有相同官能团;③不与FeCl3溶液发生显色反应。
写出其中任意一个同分异构体的结构简式___________________________________。
(5)G是重要的工业原料,用化学方程式表示G的一种重要的工业用途。__________________________________________。