I.在元素周期表中,金属性最强的元素(不包括放射性元素)是 (填元素符号,下同);最活泼的非金属元素是 ;最高价氧化物对应水化物的酸性最强的元素是 ;原子半径最小的元素是 。
II.⑴ 处于同周期的相邻两种元素A和B,A的最高价氧化物的水化物的碱性比B弱,A处于B的 边(左或右);B的原子半径比A ;若B的最外层有x个电子,则A最外层有 个电子(用含x的式子表示)。
⑵ 处于同主族的相邻两种非金属元素A和B,A的最高价氧化物的水化物的酸性比B弱,A处于B的 边(上或下);B的原子半径比A ;若B的原子序数为x且核外电子层数为3,且则A的原子序数为 (用含x的式子表示)。
某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如下图所示。
加热聚丙烯废塑料得到的产物如下表:
| 产物 |
氢气 |
甲烷 |
乙烯 |
丙烯 |
苯 |
甲苯 |
碳 |
| 质量分数/% |
12 |
24 |
12 |
16 |
20 |
10 |
6 |
(1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔。
A中残留物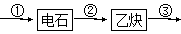 聚乙炔
聚乙炔
写出反应②③的化学方程式:__________________________。
(2)B中收集得到的物质中能使酸性KMnO4溶液褪色的物质的一氯代物有________种。
(3)锥形瓶C中观察到的现象是______________。经溴水充分吸收,剩余气体经干燥后平均相对分子质量为________。
(4)写出C中逸出的气体在工业上的两种用途__________、____________。
有机高分子化合物在日常生活中有非常广泛的应用。一种广泛应用于电器、工业交通的工程塑料DAP的结构简式是:
试回答:
(1)生产DAP工程塑料的单体的结构简式是__________________________。
(2)DAP工程塑料的单体,可以由两种有机物通过一步反应合成出来,则这两种有机物的结构简式是____________________和_______________。
最近医用化学杂志报道,用聚乙交酯纤维材料所制成的医用缝合线比天然高分子材料(如肠线)还好。聚乙交酯纤维的化学结构简式可表示为 ,它是用中间有机物
,它是用中间有机物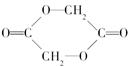 聚合而成的。
聚合而成的。
(1)试推导聚乙交酯纤维的单体______________________________________。
(2)写出有关反应的化学方程式______________________________________。
写出下列高分子化合物的化学方程式:
(1)CH2=CH—CN发生加聚反应:___________________________;
(2)CH2=CH2发生加聚反应:________________________________;
(3) 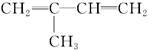 发生加聚反应:______________________________;
发生加聚反应:______________________________;
(4)乙二酸与乙二醇发生缩聚反应:________________________________;
(5) 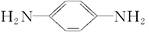 与乙二酸发生缩聚反应:_______________________________。
与乙二酸发生缩聚反应:_______________________________。
防止钢铁的腐蚀是世界级难题,每年全世界钢产量的四分之一因腐蚀而损失,根据下图回答: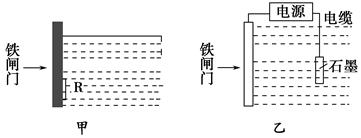
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为________________________。
(2)为降低某水库的铁闸门的被腐蚀速率,可以采用图甲方案,其中焊接在铁闸门上的固体材料R可以采用__________。
| A.铜 | B.钠 | C.锌 | D.石墨 |
(3)图乙所示方案也可降低铁闸门的被腐蚀速率,其中铁闸门应该连接在直流电源的________极。