1000mL某待测液中除含有0.2 mol·L-1的Na+外,还可能含有下列离子中的一种或多种:
| 阳离子 |
K+、NH4+、Fe3+、Ba2+ |
| 阴离子 |
Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |
现进行如下实验操作(所加试剂均过量):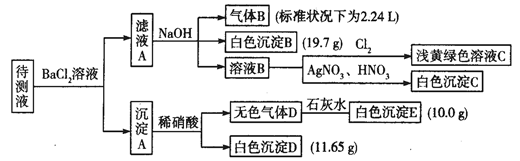
(1)写出生成白色沉淀B的离子方程式:___________________________________。
(2)待测液中肯定不存在的阳离子是_________________。
(3)若无色气体D是单一气体:
①将阴离子的物质的量浓度填入下表中(一定不存在的填“0”,不能确定的填“?”):
| 阴离子 |
Cl- |
Br- |
CO32- |
HCO3- |
SO32- |
SO42- |
| 浓度/ mol·L-1 |
|
|
|
|
|
|
②判断原溶液中K+是否存在,若存在,求其物质的量浓度的最小值,若不存在,请说明理由:
________________________________________________________________。
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是____________________________。
②沉淀A中能还原稀硝酸的成分是______________________________(写化学式)。
“温室效应”是全球关注的环境问题之一,科学家们一直致力于CO2的“组合转化”技术研究。例如将CO2和H2以1:4或1:3的比例混合,在适当条件下反应,生成H2O的同时可分别获得重要的气态能源物质A和对植物生长有调节作用的有机物B。请回答下列问题:(1)写出生成A的化学方程式:(不必写反应条件)
(2)某小组做了如下三组对照实验来证实有机物B对植物生长的调节作用。
实验I:集气瓶中放青色、未熟的水果,在空气中盖上玻璃片。
实验II: 集气瓶中放青色、未熟的水果,通入一定量的有机物B.
实验III:集气瓶中放青色、未熟的水果,瓶底放少量KMnO4 固体。
该三组实验中,水果成熟的先后顺序为(填写实验序号)。
(3)A分子的空间构型为,B分子中有个原子共面。
(4)试推测丙烯(CH2=CH-CH3)的结构或性质,下列说法中不正确的是(填字母)
a.丙烯分子中三个碳原子在同一直线上
b.丙烯可使酸性高锰酸钾溶液褪色
c.丙烯可使溴水褪色
d.丙烯能发生加成反应。
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下转化关系(图中有些反应的产物和反应的条件没有全部标出)。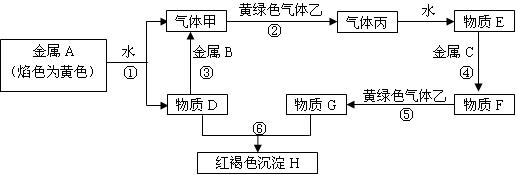
请根据图中信息回答下列问题:
(1)写出下列物质的化学式:B ________、C________、H _________、丙__________
(2)写出下列反应离子方程式:
反应①____________________反应③__________________________
(3)反应⑤属于下列反应类型中_______________(填写序号)。
A.氧化还原反应 B.分解反应 C.化合反应 D.复分解反应
将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
(1)下列说法正确的是____________。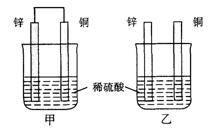
| A.甲、乙均为化学能转变为电能的装置 |
| B.乙中铜片上没有明显变化 |
| C.甲中铜片质量减少、乙中锌片质量减少 |
| D.两烧杯中溶液的pH均增大 |
(2)在相同时间内,两烧杯中产生气泡的速度:甲____乙(填“>”、“<“或“=”)。
(3)当甲中产生1.12L(标准状况)气体时,通过导线的电子数目为_______________。
(4)当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为_________________。
已知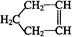 可简写为
可简写为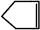 。降冰片烯的分子结构可表示为:
。降冰片烯的分子结构可表示为: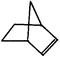
(1)降冰片烯的分子式为__________。
(2)降冰片烯的一种同分异构体(含有一个六元环的单环化合物)的结构简式为__________。
(3)有关降冰片的说法不正确的是__________。
A能溶于水 B能发生氧化反应
C能发生加成反应 D常温常压下为气体
已知由短周期元素组成的A、B、C、D、E五种化合物,它们所含原子数目依次为2、3、4、5、6,其中A、B、C、E含有18个电子,D含有10个电子。请回答:
(1)A的化学式是:,用电子式表示B的形成过程。
(2)若C为第一和第三周期元素组成的化合物,C在空气中能够自燃生成两种常见的氧化物,化学方程式是。
(3)若C为第一和第二周期元素组成的化合物,在C的溶液中加入少量二氧化锰,有无色气体生成,则C分子中化学键的类型有。