某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。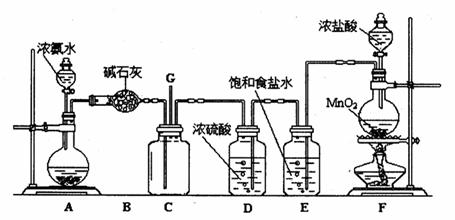
请回答下列问题:
(1) F中发生反应的化学方程式为 ;
(2)C中发生的反应为:8NH3 + 3Cl2=== N2 + 6NH4Cl ,其中氧化剂与还原剂的物质的量之比为 ;当a mol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗数常数为 mol-1(用含a、b的代数式表示);
(3) 将F制得的氯气通人含74g Ca(OH)2的石灰乳中,最多可制得漂白粉 g。
氯水中含有多种成分,因而具有多得性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量)。能证明氯水具有漂白性的是(填“a”、“b”、“c”或“d”)。C过程中的现象是 ,b过程中的离子方程式为。a过程中的化学方程式为 。

有四种钠的化合物W、X、Y、Z,在一定条件下能发生如下反应(反应条件略):
① W X + CO2 + H2O;② Z + CO2
X + CO2 + H2O;② Z + CO2 X + O2;
X + O2;
③ Z + H2O Y + O2; ④ X + Ca(OH)2
Y + O2; ④ X + Ca(OH)2 Y + CaCO3
Y + CaCO3
⑴请根据以上反应式,写出下列物质的化学式:
W ,X ,Y ,Z 。
⑵除去W溶液中混有的少量X溶液的方法是(用化学方程式表示)。
(1)鉴别NaCl溶液和Na2CO3的试剂是 ,离子方程式为
(2)除去混入SiO2中少量Al2O3杂质的试剂是 ,离子方程式为
(3)除去Na2CO3粉末中混入的NaHCO3杂质用 方法,化学方程式为
以下是有关物质相互转化的关系图,其中A俗称铁红,甲为强酸,乙为还原性气体,丙为强碱溶液,G为红褐色沉淀,I的颜色呈浅绿色。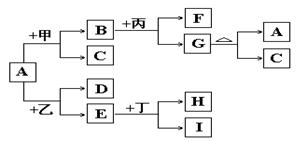
(1)若F是由Na+和SO42-组成的溶液,则甲的化学式是,列举A物质的一种用途。
(2)若D是能使澄清石灰水变浑浊的气体,则乙的化学式为 ,丁属于单质、酸、碱中的;在I溶液中加入氢氧化钠溶液,可以观察到的现象是,对应的离子方程式和化学方程式依次是,
;
(3)写出G A+C的化学方程式:。
A+C的化学方程式:。
(4)若A中混有杂质Al2O3,除去杂质的方法是加入过量的,该反应的离子方程式为。
(5)由E和A组成的混合物与稀H2SO4作用,固体恰好溶解,所得溶液中不含Fe3+,且生成的Fe2+与H2的物质的量之比为4:1。则反应物中Fe2O3、Fe、H2SO4的物质的量之比为________。
有A、B、C、D四种无色气体,
①A能使湿润的红色石蕊试纸变蓝;
②一定条件下,A可以与B反应生成C,C遇空气变为红棕色;
③D与A混合生成白烟;
④D的浓溶液与软锰矿(主要成分是MnO2)在加热条件下反应可制取黄绿色气体E;按要求回答下列问题:
(1)写出②化学方程式;
(2)写出④的离子方程式;
(3)气体E有毒,实验室一般用吸收,该反应的离子方程式是__________________________________。