二氧化氯()是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2比,不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(1)在的制备方法中,有下列两种制备方法:
方法一:↑↑
方法二↑↑:
用方法二制备的更适合用于饮用水的消毒,其主要原因是。
(2)用处理过的饮用水(为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子()。2001年我国卫生部规定,饮用水中的含量应不超过0.2。饮用水中、的含量可用连续碘量法进行测定。被还原为、的转化率与溶液的关系如图所示。

当≤2.0时,也能被还原成。
反应生成的I2用标准溶液滴定:
①请写出≤2.0时,与反应的离子方程式。
②请完成相应的实验步骤:
步骤1:准确量取水样加入到锥形瓶中。
步骤2:调节水样的为7.0~8.0。
步骤3:加入足量的晶体。
步骤4:加入少量淀粉溶液,用溶液滴定至终点,消耗溶液。
步骤5:。
步骤6:再用溶液滴定至终点,消耗溶液。
③根据上述分析数据,测得该饮用水样中浓度为用含字母的代数式表示)
④若饮用水中的含量超标,可向其中加入适量的将还原成,该反应的氧化产物是(填化学式)。
如图所示为常见气体制备、干燥、性质验证和尾气处理的部分仪器装置(加热及固定装置均略去),仪器装置可任意选择,必要时可重复选用。
请回答下列问题:
(1)在装置A的圆底烧瓶中装入锌片,分液漏斗中装入稀硫酸,以验证H2的还原性并检验其氧化产物。
①若按顺序A→D→B→B→C连接时,则两次使用的装置B中所盛放药品的化学式依次为CuO、(填化学式)。
②检验装置的气密性后,在加热装有CuO的装置B前必须进行的操作是。
(2)在装置A的锥形瓶中装入Na2O2,分液漏斗中装入浓氨水,装置B中装入固体催化剂,以进行氨的催化氧化。
①若装置的连接顺序为A→C→B→C,则装置B中氨的催化氧化反应的化学方程式为,装置B中可能观察到的现象是。
②若把装置A制得的气体与Cl2混合在一起,产生白烟,写出反应的化学方程式。该反应体现了氨的性。
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得。已知:Na2S2O3在酸性溶液中不能稳定存在。
(1)某研究小组设计的制备Na2S2O3·5H2O的装置和部分操作步骤如下。
Ⅰ.打开K1关闭K2,向圆底烧瓶中加入足量浓硫酸,加热。
Ⅱ.C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少,当C中溶液的pH 接近7时,打开K2,关闭K1即停止C中的反应,停止加热。
Ⅲ.过滤C中的混合液。
Ⅳ.将滤液经过、、过滤、洗涤、烘干,得到产品Na2S2O3·5H2O。
①Ⅱ中,“当C中溶液的pH接近7时即停止C中的反应”的原因是(用离子方程式表示)。
②Ⅳ中,操作步骤是、。
③装置B中盛放的试剂是(填化学式)溶液。
④有一小组在实验中发现,二氧化硫气体产生缓慢以致后续现象不明显,但又不存在气密性问题,请你推测可能的原因。
(2)常用Na2S2O3溶液测定废水中Ba2+的浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量 K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过KI溶液,充分反应后得混合溶液V mL,将其平均分成4等份,加入淀粉溶液作指示剂,用0.001 0 mol·L-1的Na2S2O3溶液进行滴定,反应完全时,相关数据记录如下表所示:
| 编号 |
1 |
2 |
3 |
4 |
| 消耗Na2S2O3标准 |
||||
| 溶液的体积/mL |
18.02 |
17.98 |
18.00 |
20.03 |
部分反应离子方程式为:
①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;
②I2+2S2O32-=2I-+S4O62-。
则判断达到滴定终点的现象是,废水中Ba2+的物质的量浓度_。
为了探究SO2与Na2O2的反应是否类似于CO2与Na2O2的反应,甲同学设计了如图所示的实验装置,回答下列问题:
(1)移开棉花,将带火星的木条放在C试管口,未见木条复燃,甲同学因此认为SO2与Na2O2的反应不同于CO2。请按甲同学的观点写出反应的化学方程式。
(2)乙同学认为无论反应原理如何,最终都有O2产生,乙同学的理由是。按照乙同学的观点,该装置需做的改进是
。
(3)假设Na2O2完全反应,反应后B装置中固体生成物可能是:①Na2SO3;②Na2SO4;③Na2SO3和Na2SO4。
请设计实验方案检验,写出实验步骤以及预期现象和结论,完成下表:
限选试剂:2 mol·L-1 HCl溶液,1 mol·L-1 HNO3溶液,1 mol·L-1 BaCl溶液,1 mol·L-1 Ba(NO3)2溶液,0.01 mol·L-1 KMnO4酸性溶液。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取B中的少量固体样品于试管中,滴加足量蒸馏水,溶解,然后取少量待测液分别置于Ⅰ、Ⅱ试管中 |
固体完全溶解 |
| 步骤2:往Ⅰ试管中加入,再滴加 |
, |
| 则证明生成物中含Na2SO4 |
|
| 步骤3:往Ⅱ试管中 |
|
| 若, |
|
| 则证明生成物中有Na2SO3;若 |
|
| 则说明生成物中没有Na2SO3。 |
(4)生成物中亚硫酸钠含量的测定:
①取a g生成物配制成100 mL溶液,取10.00 mL该溶液于锥形瓶中,加入几滴淀粉溶液作指示剂,用0.010 0 mol·L-1碘水进行滴定,滴定终点现象为。记录数据,重复滴定2次,平均消耗碘水20.00 mL。
②计算:生成物中亚硫酸钠的质量分数为。
一定浓度NaHCO3溶液与CuSO4溶液反应后生成了蓝绿色颗粒状沉淀。就沉淀成分提出了如下三种假设:
假设一:沉淀是CuCO3;假设二:沉淀是Cu(OH)2;
假设三:沉淀是CuCO3和Cu(OH)2的混合物。
(1)写出假设二,沉淀是Cu(OH)2生成的理由(用离子方程式表示);
(2)为了探究沉淀的成分,取出了一部分沉淀,滴加稀盐酸,有气体放出。凭此现象,判断沉淀中含有_;
(3)为了进一步探究沉淀的成分,进而确定假设中何种假设成立,设计实验,装置图如下: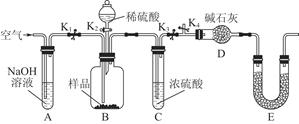
①研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为_ 、洗涤、干燥;
②装置E中药品的名称是__作用为__;
③实验过程中有以下操作步骤:a.打开K1、K3,关闭K2、K4,通入过量空气。此步骤的作用是;
b.关闭K1、K3,打开K2、K4,充分反应,c.再通入过量空气时,活塞处于打开的是_,关闭的是_。
④若沉淀样品的质量为m g,装置D的质量增加了n g;若沉淀样品为纯净物,m、 n之间的关系为_
若假设三成立,则Cu(OH)2的质量分数为_;若不进行步骤c,则会使测得结果(填“偏高”“无影响”“偏低”)。
为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验Ⅰ 反应产物的定性探究
实验装置如图所示。(固定装置已略去)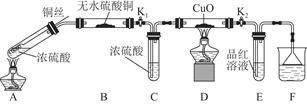
(1)A中反应的化学方程式为。
(2)F烧杯中的溶液通常是。
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是。
(5)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。实验方案为。
实验Ⅱ 反应产物的定量探究
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
资料1:
| 硫酸/mol·L-1 |
黑色物质出现的温度/℃ |
黑色物质消失的温度/℃ |
| 15 |
约150 |
约236 |
| 16 |
约140 |
约250 |
| 18 |
约120 |
不消失 |
资料2:X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。仅由上述资料可得出的正确结论是__。
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15 mol·L-1
d.硫酸浓度越大,黑色物质越快出现、越难消失
(7)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用b mol·L-1Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL。若反应消耗铜的质量为a g,则硫酸铜的产率为_。(已知:2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-)