某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,注入0.2000mol·L-1的标准NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
⑥重复以上滴定操作2-3次。
请回答:
(1)以上步骤有错误的是(填编号)____________,该错误操作会导致测定结果_____________(填“偏大”、“偏小”或“无影响”)。
(2)步骤④中,量取20.00mL待测液应使用__________________(填仪器名称),在锥形瓶装液前,留有少量蒸馏水,测定结果____________(填“大”、“偏小”或“无影响”)。
(3)步骤⑤滴定时眼睛应注视_______________;判断到达滴定终点的依据是:_________________。
(4)以下是实验数据记录表
| 滴定次数 |
盐酸体积(mL) |
NaOH溶液体积读数(mL) |
|
| 滴定前 |
滴定后 |
||
| 1 |
20.00 |
0.00 |
18.10 |
| 2 |
20.00 |
0.00 |
16.30 |
| 3 |
20.00 |
0.00 |
16.22 |
从上表可以看出,第1次滴定记录的NaOH溶液体积明显多于后两次的体积,其可能的原因是( )
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.锥形瓶用待测液润洗
C.NaOH标准液保存时间过长,有部分变质
D.滴定结束时,俯视读数
(5)根据上表记录数据,通过计算可得,该盐酸浓度为:____________mol·L-1
粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 6.0 mol·L-1盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12 L(标准状态)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填写:
(1)产物中的单质B是_________________。
(2)②中所发生的各反应的化学方程式是___________________,______________________。
(3)③中所发生的各反应的离子方程式是
___________________________________________。
(4)若溶液D的体积仍视为0.15 L,则该溶液c(Mg2+)为____________________,c(Fe2+)为_____________________。
镁是一种很活泼的金属,常用作脱硫剂、脱氧剂。在电子工业中利用镁制取硅的反应为2Mg+SiO2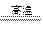 2MgO+Si(玻璃中含有一定量的二氧化硅),同时有副反应发生:2Mg+Si
2MgO+Si(玻璃中含有一定量的二氧化硅),同时有副反应发生:2Mg+Si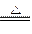 Mg2Si。Mg2Si遇盐酸迅速反应生成SiH4(硅烷)。SiH4在常温下是一种不稳定、易分解的气体。
Mg2Si。Mg2Si遇盐酸迅速反应生成SiH4(硅烷)。SiH4在常温下是一种不稳定、易分解的气体。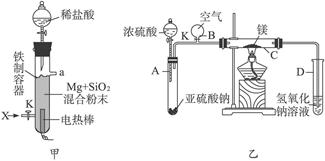
(1)图(甲)是进行Mg与SiO2反应的实验装置。
Ⅰ.由于O2的存在对该实验有较大影响,实验中应通入X气体作为保护气。X气体应选用①CO2、②N2、③H2中的________________。
Ⅱ.实验开始时,必须先通入X的气体,再接通电源加热反应物。其理由是_____________________________;当反应引发后,切断电源,反应能继续进行,其原因是_____________________________。
Ⅲ.反应结束时,待冷却至常温后,关闭K,从分液漏斗处加入稀盐酸,可观察到导管口a处有闪亮的火星。据此现象可推知____________________在空气中能自燃。
(2)图(乙)所示装置进行的实验如下:先关闭K,使A中反应进行;加热玻璃管C,可观察到C管中发出耀眼白光,产生白烟,管壁上附着有淡黄色物质。实验完成后,将C管中固体全部加入盐酸中,有臭鸡蛋气味的气体生成。
Ⅰ.C中的Mg应放在不锈钢垫片上而不能直接接触管壁,这是因为______________________。
Ⅱ.停止实验时,先打开K,再停止滴加浓硫酸并熄灭酒精灯。橡胶气胆B在实验中的作用是_______________________________。
Ⅲ.C中全部反应产物有___________、___________、___________(填化学式)。
实验室用下图所示实验装置制取纯净的CuCl2,完成下列问题: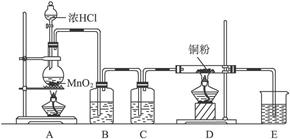
(1)实验室里,实验前检查整套装置的气密性方法是:_____________________________。
(2)装置A中发生的化学反应方程式为_____________________________。
(3)装置B的广口瓶盛__________,其作用是_____________________________________。装置C的广口瓶盛__________,其作用是___________________。装置E的烧杯中盛有,其作用是_____________________________。
(4)待充分反应后,装置D的玻璃管中剩余物呈_________色,冷却后,将制得的产物配成饱和溶液,溶液呈_________色。
有人设计了如图所示实验装置,目的是做钠与水反应实验并验证:①钠的物理性质;②钠与水反应的产物是什么?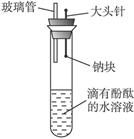
(1)当进行适当操作时还需要的仪器有_____________________________。
(2)如何进行操作?_____________________________________________。
(3)实验现象是_________________________________________________。
(创新题)做一个家庭小实验:
(1)将蜡烛点燃,并燃烧几秒钟,等火焰稳定后,在其上方撒下小苏打粉末,火焰会出现什么现象?
(2)不慎将食盐水洒在煤气灶上,观察火焰的颜色。
解释上述两实验现象产生的原因。