1体积SO2和3体积空气混合后,在450℃以上通过V2O5催化剂发生如下反应:2SO2(气)+O2(气) 2SO3(气),若在同温同压下测得反应前后混合气体的密度比为0.9:1。则反应掉的SO2是原有SO2的___________%。
2SO3(气),若在同温同压下测得反应前后混合气体的密度比为0.9:1。则反应掉的SO2是原有SO2的___________%。
根据Mg与CO2的反应推测,Na也能在CO2中燃烧,且固体产物可能为C、Na2O和Na2CO3中的两种或三种。某兴趣小组用如下装置开展两个阶段的实验探究。
【实验I】引发CO2与Na反应。操作步骤为:
①按图连接装置,检验装置气密性,并往各装置中加入试剂;
②打开装置a上活塞一段时间;
③点燃d处酒精灯,使CO2与Na充分反应。停止加热,继续通气体使双通管冷却。
回答下列问题:
(1)装置a中用到的玻璃仪器有试管和 ;(2)装置b中装入的试剂是 ;
(3)装置c的作用是 ;(4)步骤②中,当观察到 时,才能进入步骤③。
【实验Ⅱ】探究反应产物及反应机理。取反应后双通管中固体物质29.2 g进行如下实验:
①仔细观察固体,发现有黑色颗粒;
②将固体溶于足量的水并过滤、洗涤,得到1.8 g滤渣(干燥);
③将滤液加水稀释配成250 mL的溶液;
④取少量③的溶液,先加足量BaCl2溶液,观察到白色沉淀;将生成的白色沉淀过滤、洗涤、干燥,称量得固体质量为3.94g。向滤液中再加几滴酚酞试液,溶液变红;
⑤取25.00 mL③的溶液,滴加甲基橙作为指示剂,用3.0 mol·L-1盐酸滴定,消耗盐酸体积为20.00 mL。
回答下列问题:
(5)如何判断⑤中的滴定终点
(6)反应后装置d中的固体物质为 ;通过计算分析:29.2 g残留固体中,各组分的质量各是多少?
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
回答下列问题:
(1)焙烧硫铁矿的主要方程式为。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率、 。
(3)通氯气氧化后时,发生的主要反应的离子方程式为 ;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为(写化学式) 。
(4)在氧化过程中,如何检验铁元素全部以Fe3+形式存在:
(5) 如果将氯化铁晶体(FeCl3·6H2O)放在坩埚中加热灼烧,最后得到的固体为 。
(6)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g) 2SO3(g),该反应的平衡常数表达式为K= ; 工业在接触法制硫酸的生产中,采取下列哪些措施有利于提高SO2转化率 。
2SO3(g),该反应的平衡常数表达式为K= ; 工业在接触法制硫酸的生产中,采取下列哪些措施有利于提高SO2转化率 。
①V2O5作催化剂②通入过量O2③SO2、O2进行二次氧化④通入过量SO2
(I)下图是工业生产硝酸铵的流程。
(1)吸收塔C中通入空气的目的是 。A、B、C、D四个容器中的反应,属于氧化还原反应的是 (填字母)。
(2)已知:①4NH3(g) + 3O2(g) = 2N2(g) +6H2O(g)△H =-1266.8kJ/mol
②N2(g) + O2(g) = 2NO(g)△H =" +180.5" kJ/mol
写出氨高温催化氧化的热化学方程式:
(II)某合作小组同学将铜片加入稀硝酸,发现开始时反应非常慢,一段时间后反应速率明显加快。该小组通过实验探究其原因。
(3)该反应的离子方程式为___________________________________________________。
(4)提出合理假设。该实验中反应速率明显加快的原因可能是_____________________。
A.反应放热导致温度升高 B.压强增大
C.生成物有催化作用 D.反应物接触面积增大
(5)初步探究。测定反应过程中溶液不同时间的温度,结果如下表:
| 时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
35 |
50 |
60 |
70 |
80 |
| 温度/℃ |
25 |
26 |
26 |
26 |
26 |
26 |
26.5 |
27 |
27 |
27 |
27 |
结合实验目的和表中数据,你得出的结论是__________________________________。
(6)进一步探究。查阅文献了解到化学反应的产物(含中间产物)可能对反应有催化作用,请完成以下实验设计表并将实验目的补充完整:
| 实验 编号 |
铜片 质量/g |
0.1mol·L-1的 硝酸体积/mL |
硝酸铜 晶体/g |
亚硝酸钠 晶体/g |
实验目的 |
| ① |
5 |
20 |
_______ |
_______ |
实验①和②探究_________的影响;实验①和③探究亚硝酸根的影响。 |
| ② |
5 |
20 |
0.5 |
0 |
|
| ③ |
5 |
20 |
0 |
0.5 |
液晶高分子材料应用广泛。新型液晶基元------化合物Ⅳ的合成线路如下:
(1)化合物Ⅰ的分子式为__________ ,1mol化合物Ⅰ完全燃烧消耗_____molO2。
(2)CH2=CH-CH2Br与NaOH水溶液反应的化学方程式为_____(注明条件)。
(3)写出符合下列条件的化合物Ⅰ的同分异构体的结构简式。
I. 苯环上有3个取代基 II.苯环上一溴代物只有2种III.能发生银镜反应
(4)下列关于化合物Ⅱ的说法正确的是_______(填字母)。
| A.属于烯烃 | B.能与FeCl3溶液反应呈紫色 |
| C.一定条件下能发生加聚反应 | D.最多能与4molH2发生加成反应 |
(5)反应③的反应类型是____________。在一定条件下,化合物 也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ。Ⅴ的结构简式是______________。
也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ。Ⅴ的结构简式是______________。
资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ,ΔH=—76.0 kJ·mol-1,该反应中每放出38 kJ热量,转移电子的物质的量为mol.
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH<0
CH4(g)+2H2O(g) ΔH<0
①向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO20.2mol·L—1,H20.8mol·L—1, CH40.8mol·L—1,H2O1.6mol·L—1,起始充CO2和H2的物质的量分别为、。CO2的平衡转化率为
②现有两个相同的恒容绝热(与外界没有热量交换)密闭容器I、II,在I中充人1 mot CO2,和4 molH2,在II中充人1 mol CH4和2 mol H2 O(g) , 300℃下开始反应。达到平衡时,下列说法正确的是(填字母)。
| A.容器I、II中正反应速率相同 |
| B.容器I、II中CH4的物质的量分数相同 |
| C.容器I中CO2的物质的量比容器II中的多 |
| D.容器I中CO2的转化率与容器II中CH4的转化率之和小于1 |
(3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示: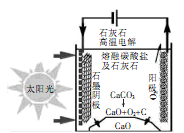
①上述生产过程的能量转化方式是
②上述电解反应在温度小于900 0C时进行碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,则阳极的电极反应式为,阴极的电极反应式为