用NA表示阿伏加德罗常数的值。下列叙述正确的是


A.25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA |
B.标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA |
C.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA |
D.标准状况下,22.4L甲醇中含有的氧原子数为1.0NA |
最早使用的化学电源是锌锰电池,即大家所熟悉的干电池(dry cell),其结构如下图所示:尽管这种电池的历史悠久,但对它的电化学过程尚未完全了解。一般认为,放电时,电池中的反应如下:
E极:2MnO2+2H2O+2e-="==" 2MnO(OH)+2OH-
F极:Zn+2NH4Cl -2e-===Zn(NH3)2Cl2+2H+
总反应式:2MnO2+Zn+2NH4Cl ="==" 2MnO(OH)+Zn(NH3)2Cl2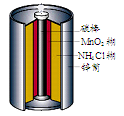
下列说法正确的是
| A.E极是电池的正极,发生的是氧化反应 |
| B.F极是电池的负极,发生的是氧化反应 |
| C.从结构上分析,锌锰电池应属于可充电电池 |
| D.锌锰电池内部发生的氧化还原反应是可逆的 |
下列烧杯中盛放的都是稀硫酸,不能构成原电池的是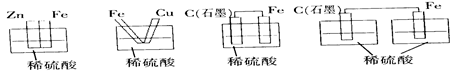
A B C D
将纯锌片和纯铜片按图示方式插入同浓度同体积的稀硫酸中一段时间,以下叙述正确的是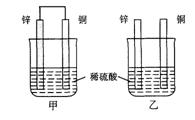
| A.两烧杯中铜片表面均无气泡产生 |
| B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的pH均增大 |
| D.产生气泡的速度甲比乙慢 |
N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程中正确的是
| A.1/2 N2H4(g)+ 1/2 O2(g)= 1/2 N2(g)+ H2O(l)△H=+257kJ·mol-1 |
B.N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-133.5kJ·mol-1 |
C.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=+534kJ·mol-1 |
D.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ·mol-1 |
下列说法正确的是
| A.酸性氧化物在常温下均呈气态 |
| B.元素的非金属性越强,对应离子的还原性也越强 |
| C.非金属元素间相互结合形成的化合物一定是共价化合物 |
| D.共价化合物的分子中一定不含离子键 |