据中国卫生部通报,中国内地已有多例H7N9流感确诊病例。达菲是治疗H7N9型流感的有效药物,莽草酸是合成达菲的重要原料,它们的结构简式如下图,下列关于这两种有机化合物的说法正确的是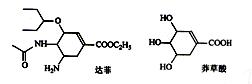
| A.莽草酸不能使溴水褪色 |
| B.都能发生水解反应 |
| C.达菲的分子式为C16H28O4N2 |
| D.1 mol莽草酸能与4mol NaOH反应 |
参照反应Br + H2 HBr +H的能量对反应历程的示意图,下列对上述正反应叙述中正确的
HBr +H的能量对反应历程的示意图,下列对上述正反应叙述中正确的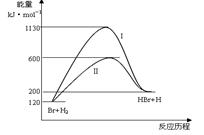
| A.反应热:过程I>过程Ⅱ |
| B.反应速率:过程Ⅱ=过程I |
| C.该反应为吸热反应 |
| D.过程I使用了催化剂 |
25℃时,有关弱酸的电离平衡常数如下,下列有关说法正确的是
| 弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数(25℃) |
1.8×10-5 |
4.9×10-10 |
K1=4.3×10-7 K2=5.6×10-11 |
A.等物质的量浓度的各溶液pH关系为pH(CH3COONa)>pH(Na2CO3)>pH(NaCN)
B.a mol·L-1HCN溶液与b mol·L-1 NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定小于b
C.0.1 mol·L-1CH3COOH溶液中逐滴加入水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
下列说法正确的是
A.Ca2+、K+、Cl-、S2-四种离子的半径依次减小
B.熔融的NaHS04中阴、阳离子的数目比为1:2
C.等物质的量的LiH、LiD、LiT三种物质的质子数之比为4:5:6
D.3 g乙酸分子中含有的共用电子对数是0.4NA
用Pt做电极,电解含C(Cu2+): C(Na+): C(Cl-)=1:2:4的混合溶液,在任何情况下,阴、阳两极下不可能同时发生的反应是
| A.阴极:2H++2e-=H2↑阳极:4OH-- 4e-=2H2O+O2↑ |
| B.阴极:2H++2e-=H2↑阳极:2Cl--2e-=Cl2↑ |
| C.阴极:Cu2++2e-=Cu阳极:4OH-- 4e-=2H2O+O2↑ |
| D.阴极:Cu2++2e-=Cu阳极:2Cl--2e-=Cl2↑ |